Kromium
Kromium adalah suatu unsur kimia dalam tabel periodik yang memiliki lambang Cr dan nomor atom 24.
Dinamakan setelah Pierre dan Marie Curie, curium adalah logam keras, rapuh, keperakan yang perlahan menodai di udara kering pada suhu kamar. Curium tidak terjadi secara alami; itu diproduksi secara artifisial dalam reaktor nuklir oleh penangkapan neutron berturut-turut oleh plutonium dan isotop amerisium.
Efek kesehatan dari Cr
Curium dapat dicerna ke dalam tubuh dengan makan makanan, minum air minum, atau menghirup udara. Penyerapan gastrointestinal dari makanan atau air adalah sumber yang paling mungkin untuk menyimpan curium secara internal pada populasi umum. Setelah konsumsi, sebagian besar curium dikeluarkan dari tubuh dalam beberapa hari dan tidak pernah memasuki aliran darah; hanya sekitar 0,05% dari jumlah yang tertelan diserap ke dalam aliran darah. Dari curium yang mencapai darah, sekitar 45% disimpan di hati yang dipertahankan dengan waktu paruh biologis 20 tahun, dan 45% disimpan di tulang dengan waktu paruh biologis 50. tahun (dengan model sederhana yang tidak mencerminkan redistribusi menengah). Sebagian besar dari 10% sisanya langsung diekskresikan. Curium dalam rangka diendapkan terutama pada permukaan endosteal tulang mineral dan hanya didistribusikan kembali secara perlahan ke seluruh volume tulang.
Umumnya, curium membahayakan kesehatan hanya jika masuk ke dalam tubuh; namun, ada risiko eksternal kecil yang terkait dengan isotop ganjil, yaitu curium-243, curium-245, dan curium-247. Rute utama paparan adalah konsumsi makanan dan air yang mengandung curium dan inhalasi curium dengan debu kotor. Tertelan umumnya melibatkan paparan sumber terdekat dari debu kotor. Karena curium dibawa ke dalam tubuh jauh lebih mudah melalui inhalasi daripada melalui konsumsi, kedua rute paparan mungkin penting. Masalah kesehatan utama adalah tumor tulang yang dihasilkan dari radiasi pengion yang dipancarkan oleh isotop kurium yang disimpan di permukaan tulang.
Kanker rangka diamati pada tikus yang terpapar dengan injeksi intravena curium-242 dan curium-244 dan kanker paru-paru dan hati pada tikus yang terpapar melalui inhalasi.
Efek Cr pada lingkungan
Pengujian atmosfer senjata nuklir, yang telah dihentikan di seluruh dunia sejak tahun 1980, telah menghasilkan lebih banyak curium di lingkungan. Kecelakaan dan pelepasan lain dari produksi senjata telah menyebabkan kontaminasi lokal. Curium oksida adalah bentuk yang paling umum di lingkungan.
Curium pada umumnya tidak larut dan melekat sangat erat pada partikel tanah. Konsentrasi curium di tanah berpasir sekitar 4000 kali lebih tinggi daripada di air interstisial (dalam pori-pori di antara partikel tanah), dan ia mengikat lebih erat ke tanah lempung di mana tingkat konsentrasinya bahkan lebih tinggi (18000).

Pengunaan Kromium
Metalurgi
Efek penguatan dari pembentukan karbida logam stabil pada batas butir dan kenaikan daya tahan korosi membuat kromium menjadi bahan paduan yang penting untuk baja.
Kekerasan yang relatif tinggi dan ketahanan korosi dari kromium murni membuatnya menjadi penyalut permukaan yang baik, saat ini masih merupakan salutan logam yang paling “populer” dengan daya tahan kombinasi yang tak tertandingi. Lapisan tipis kromium diendapkan pada permukaan logam yang telah diolah dengan teknik penyepuhan elektrik.
Pewarna dan pigmen
Rubi sintetis dan laser pertama
Rubi alami adalah kristal korundum (aluminium oksida) yang berwarna merah (jenis paling langka) karena adanya ion kromium(III) (permata korundum berwarna lain disebut safir). Rubi buatan berwarna merah dapat juga diperoleh melalui doping kromium(III) ke dalam kristal korundum buatan, sehingga membaut kromium suatu syarat untuk pembuatan rubi sintetis.[41] Kristal rubi sintetis semacam ini adalah dasar untuk laserpertama, diproduksi tahun 1960, yang bergantung pada emisi terstimulasi cahaya dari atom kromium dalam kristal tersebut.
Pengawet kayu
Garam kromium(VI) digunakan untuk pengawet kayu karena toksisitasnya. Sebagai contoh, tembaga arsenat terkromasi (chromated copper arsenate, CCA) digunakan dalam pengolahan kayu untuk melindungi kayu dari pelapukan jamur, serangga yang menyerang kayu, termasuk rayap, dan penggerek laut. Formulasinya mengandung kromium berbasis oksida CrO3 antara 35,3% dan 65,5%. Di Amerika Serikat, 65.300 metrik ton larutan CCA digunakan pada tahun 1996.
Penyamakan
Garam kromium(III), terutama alum krom dan kromium(III) sulfat, digunakan dalam penyamakan kulit. Kromium(III) menstabilkan kulit dengan mengikat silang serat kolagen. Kulit yang disamak dengan kromium mengandung antara 4 dan 5% kromium, yang berikatan kuat dengan protein.
Meskipun bentuk kromium yang digunakan untuk menyamak bukanlah varietas heksavalen yang toksik, tetap ada minat dalam mengelola kromium dalam industri penyamakan seperti perolehan kembali dan penggunaan ulang, daur ulang langsung/tak langsung, menggunakan sedikit kromium atau penyamakan “nirkrom” dilakukan untuk pengelolaan kromium yang lebih baik dalam penyamakan.
Bahan refraktori
Ketahanan terhadap panas yang tinggi dan tingginya titik lebur menjadikan kromit dan kromium(III) oksida suatu bahan untuk aplikasi refraktori suhu tinggi, seperti tanur tinggi, tanur semen, cetakan untuk membakar batu bata dan pasir peleburan untuk pengecoran logam. Pada aplikasi ini, bahan refraktori dibuat dari campuran kromit dan magnesit. Penggunaannya menurun karena regulasi lingkungan tentang kemungkinan pembentukan kromium(VI).
Katalis (suatu zat yang mempercepat laju reaksi reaksi kimia pada suhu tertentu)
Beberapa senyawa kromium digunakan sebagai katalis untuk pengolahan hidrokarbon. Contohnya, katlis Phillips, dibuat dari oksida kromium, digunakan untuk produksi sekitar setengah polietilena dunia. Oksida campuran Fe-Cr digunakan sebagai katalis suhu tinggu untuk reaksi pergeseran gas air. Tembaga kromit adalah katalis hidrogenasi yang berguna.
Kegunaan lain
- Kromium(IV) oksida (CrO2) adalah senyawa magnetik. Bentuk idealnya anisotropi, yang memberikan koersivitas tinggi dan sisa magnetisasi, membuatnya sebagai senyawa superior terhadap γ-Fe2O3. Kromium(IV) oksida digunakan untuk pabrikasi pita magnetik yang digunakan dalam pita audio kinerja tinggi dan kaset audio.[49] Kromat dapat mencegah korosi baja pada kondisi basah, dan oleh karena itu kromat ditambahkan pada lumpur pengeboran.[50]
- Kromium(III) oksida (Cr2O3) adalah logam poles yang dikenal sebagai rona hijau.
- Asam kromat adalah oksidator kuat dan senyawa yang berguna untuk membersihkan peralatan gelas laboratorium dari senyawa organik renik apapun. Ia disiapkan dengan melarutkan kalium dikromat dalam asam sulfat pekat, yang kemudian digunakan untuk membilas peralatan. Natrium dikromat kadang-kadang digunakan karena kelarutannya yang lebih tinggi (masing-masing 50 g/L vs 200 g/L). Penggunaan larutan pembersih dikromat sekarang sudah dihapus karena toksisitasnya yang tinggi dan masalah lingkungan. Larutan pembersih modern sangat efektif dan bebas kromium.
- Kalium dikromat adalah pereaksi kimia, yang digunakan untuk titrasi.
- Alum krom adalah kromium(III) kalium sulfat dan digunakan sebagai mordan (yaitu zat fiksasi) untuk pewarna kain dan penyamakan.

Sifat Fisika
Fase: padat
Titik lebur: 2180 K (1907 °C, 3465 °F)
Titik didih: 2944 K (2671 °C, 4840 °F)
Kepadatan mendekati s.k.: 7,19 g/cm3
saat cair, pada t.l. 6,3 g/cm3
Kalor peleburan: 21,0 kJ/mol
Kalor penguapan: 339,5 kJ/mol
Kapasitas kalor molar: 23,35 J/(mol·K)
Sifat Atom
Bilangan oksidasi: 6, 5, 4, 3, 2, 1, -1, -2 oksida asam kuat
Elektronegativitas Skala Pauling: 1,66
Energi ionisasi ke-1: 652,9 kJ/mol
ke-2: 1590,6 kJ/mol
ke-3: 2987 kJ/mol
Jari-jari atom empiris: 128 pm
Jari-jari kovalen: 139±5 pm
Senyawa Kromium
Kromium adalah logam transisi anggota golongan 6. Kromium(0) mempunyai konfigurasi elektron [Ar]3d54s1, karena energi yang lebih rendah dari konfigurasi spin tinggi.
Kromium menunjukkan rentang tingkat oksidasi yang lebar, dengan +3 adalah yang paling stabil; keadaan +3 dan +6 adalah yang paling umum dalam senyawa kromium, sementara +1, +4, dan +5 jarang.
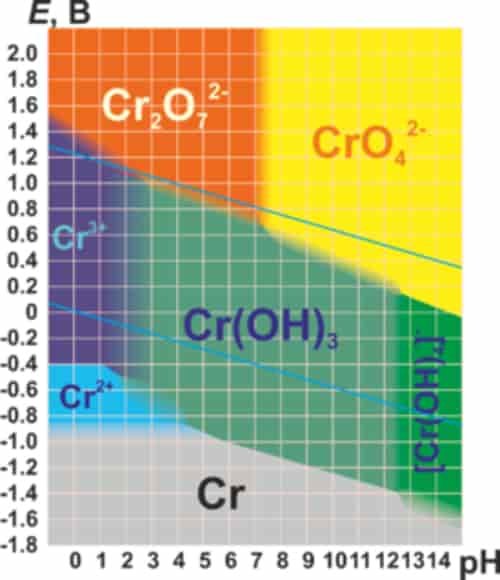
Berikut adalah diagram Pourbaix untuk kromium dalam air murni, asam perklorat atau natrium hidroksida:
Kromium(0)
Banyak senyawa kromium(0) yang diketahui. Sebagian besar adalah turunan kromium heksakarbonil atau bis(benzena)kromium.
Kromium(I)
Sebagian besar senyawa Cr(I) diperoleh melalui oksidasi kompleks Cr(0) oktahedral yang kaya elektron. Kompleks Cr(I) lainnya mengandung ligan siklopentadienil. Sesuai verifikasi menggunakan difraksi sinar-X, ikatan kuintupel Cr-Cr (panjang 183,51(4) pm) telah pula dideskripsikan. Ligan monodentat yang sangat besar menstabilkan senyawa ini dengan melindungi ikatan kuintupel dari reaksi lebih lanjut.
Kromium(II)
Banyak senyawa kromium(II) yang diketahui, termasuk kromium(II) klorida, CrCl2, yang stabil dalam air, dan dapat dibuat melalui reduksi kromium(III) klorida dengan seng. Larutan biru terang yang dihasilkan hanya stabil pada pH netral.[6] Banyak karboksilat kromo (nama trivial untuk ion kromium(II)) yang diketahui, terutama kromo asetat (Cr2O2CCH3)4) yang berwarna merah dan memiliki ikatan kuadrupel.
Kromium(III)
Ion kromium(III) cenderung membentuk kompleks oktahedral. Warna kompleks ini ditentukan oleh ligan yang menempel pada pusat Cr. Kromium(III) klorida hidrat yang tersedia di pasaran adalah kompleks [CrCl2(H2O)4]Cl yang berwarna hijau tua. Senyawa kerabat dekatnya memiliki warna yang berbeda: [CrCl(H2O)5]Cl2 hijau pucat dan [Cr(H2O)6]Cl3 ungu.
Jika kromium(III) klorida bebas air yang berwarna hijau dilarutkan dalam air, larutan hijau berubah menjadi ungu setelah beberapa saat karena klorida dalam lingkungan koordinasi bagian dalam digantikan oleh air. Reaksi semacam ini juga teramati dengan larutan krom alum dan garam kromium(III) yang dapat larut dalam air lainnya.
Kromium(III) hidroksida (Cr(OH)3) bersifat amfoter, melarutkannya dalam larutan asam membentuk [Cr(H2O)6]3+ dan dalam larutan basa membentuk [Cr(OH)6]3−. Senyawa ini didehidrasi dengan pemanasan membentuk kromium(III) oksida (Cr2O3) yang berwarna hijau, suatu oksida stabil dengan struktur kristal yang identik seperti yang terdapat pada korundum.
Kromium(VI)
Halida kromium(VI) juga diketahui dan termasuk heksafluorida CrF6 dan kromil klorida (CrO2Cl2).
Natrium kromat diproduksi dalam skala industri melalui pemanggangan oksidatif bijih kromit dengan kalsium atau natrium karbonat. Oleh karena itu, spesies dominan, berdasarkan hukum aksi massa, ditentukan oleh pH larutan.
Perubahan dalam kesetimbangan nampak berdasarkan perubahan warna dari kuning (kromat) menjadi jingga (dikromat), seperti ketika asam ditambahkan ke dalam larutan netral kalium kromat. Pada pH yang lebih rendah lagi, dimungkinkan kondensasi lebih lanjut menjadi oksianion kromium yang lebih kompleks.
Baik anion kromat dan dikromat adalah oksidator kuat pada pH rendah:
Namun, sifat oksidator mereka melemah pada pH tinggi:
Senyawa kromium(VI) dalam larutan dapat dideteksi dengan menambahkan larutan asam hidrogen peroksida. Terbentuk kromium(VI) peroksida (CrO5) berwarna biru tua yang tidak stabil, yang dapat distabilkan sebagai aduk eter CrO5·OR2.
Asam kromat mempunyai rumus hipotetis H2CrO4. Penjelasan ini masih sumir, meskipun banyak kromat dan dikromat yang diketahui telah didefinisikan dengan baik. Kromium(VI) oksida CrO3 yang berwarna merah tua, anhidrida asam dari asam kromat, dipasarkan dalam skala industri sebagai “asam kromat”. Ia dapat dibuat dengan mencampur asam sulfat dengan dikromat, dan merupakan suatu oksidator kuat.
Kromium(V) dan kromium(IV)
Keadaan oksidasi +5 hanya terdapat dalam beberapa senyawa tetapi merupakan zat antara dalam banyak reaksi yang melibatkan oksidasi dengan kromat. Satu-satunya senyawa biner adalah kromium(V) fluorida yang mudah menguap (CrF5). Padatan merah ini memiliki titik leleh 30 °C dan titik didih 117 °C. Ini dapat disiapkan dengan memberi perlakuan logam kromium dengan fluor pada suhu 400 °C dan tekanan 200 bar. Peroksokromat(V) adalah contoh lain dari keadaan oksidasi +5.
Kalium peroksokromat (K3[Cr(O2)4]) dibuat dengan mereaksikan kalium kromat dengan hidrogen peroksida pada suhu rendah. Senyawa merah coklat ini stabil pada suhu kamar namun terurai secara spontan pada 150–170 °C.
Senyawa kromium(IV) (dengan tingkat oksidasi +4) sedikit lebih umum daripada kromium(V). Tetrahalidanya, CrF4, CrCl4, dan CrBr4, dapat diproduksi dengan memberi perlakukan trihalidanya (CrX3) dengan halogen yang sesuai pada suhu tinggi. Senyawa-senyawa tersebut rentan terhadap reaksi disproporsionasi dan tidak stabil dalam air.

Isotop Kromium
Kromium alami tersusun atas tiga isotop stabil; 52Cr, 53Cr dan 54Cr, dengan 52Cr adalah yang paling melimpah (kelimpahan alami 83,789%). Sebanyak 19 radioisotop telah dikarakterisasi, dengan yang paling stabil adalah 50Cr dengan waktu paruh (lebih dari) 1,8×1017 tahun, dan 51Cr dengan waktu paruh 27,7 hari. Seluruh isotop radioaktif sisanya mempunyai waktu paruh kurang dari 24 jam dan mayoritas kurang dari 1 menit. Unsur ini juga memiliki 2 isotop meta stabil.
53Cr adalah produk peluruhan radiogenik dari 53Mn (waktu paruh = 3,74 juta tahun) dan isotop kromium biasanya terkolokasi (dan bergabung) dengan isotop mangan. Keadaan ini berguna dalam geologi isotop. Rasio isotop mangan-kromium memperkuat bukti dari 26Al dan 107Pd tentang asal usul sistem tata surya.
Variasi dalam rasio 53Cr/52Cr dan Mn/Cr dari beberapa meteorit menandakan rasio awal 53Mn/55Mn yang mengarah pada komposisi isotopik Mn-Cr seharusnya merupakan hasil peluruhan in situ 53Mn dalam badan planet yang berbeda. Sehingga, 53Cr memberi bukti tambahan bahwa proses nukleosintesis terjadi segera sebelum peleburan sistem tata surya.
Isotop kromium berada dalam kisaran massa atom dari 43 u (43Cr) hingga 67 u (67Cr). Moda peluruhan utama sebelum isotop stabil palling melimpah, 52Cr, adalah tangkapan elektron, sedangkan moda utama setelahnya adalah peluruhan beta.[17] 53Cr telah diajukan sebagai proksi untuk konsentrasi oksigen atmosfer.
Isotop Kromium terstabil
| Isotop | Kelimpahan | Waktu paruh (t1/2) | Moda peluruhan | Produk | |
|---|---|---|---|---|---|
| 50Cr | 4.345% | > 1,8×1017y | εε | 50Ti | |
| 51Cr | syn | 27,7025 d | ε | 51V | |
| γ | – | ||||
| 52Cr | 83,789% | 52Cr stabil dengan 28 neutron | |||
| 53Cr | 9,501% | 53Cr stabil dengan 29 neutron | |||
| 54Cr | 2,365% | 54Cr stabil dengan 30 neutron | |||

Sejarah Kromium
- Senjata yang ditemukan dalam lubang penguburan berasal dari Pasukan Terakota Dinasti Qin abad ke-3 SM di dekat Xi’an, China telah dianalisis oleh para arkeolog. Meskipun terkubur lebih dari 2.000 tahun, ujung perunggu kuno dari baut busur silang dan pedang yang ditemukan pada situs tersebut menunjukkan hanya sedikit korosi, mungkin karena perunggu sengaja disalut lapisan tipis kromium oksida. Namun, lapisan oksida bukan logam kromium atau lapisan krom seperti yang kita ketahui saat ini.
- Kromium ditemukan sebagai unsur setelah ia menarik perhatian dunia Barat dengan kristal mineral merahnya, krokoit (timbal(II) kromat), yang ditemukan pada tahun 1761 dan awalnya digunakan sebagai pigmen. Hampir semua kromium yang diekstraksi secara komersial berasal dari sumber tunggal, bijih kromit, yang merupakan besi kromium oksida (FeCr2O4}). Kromit sekarang merupakan sumber utama kromium untuk pigmen.
- Mineral kromium sebagai pigmen menarik perhatian dunia Barat pada abad ke-18. Pada 26 Juli 1761, Johann Gottlob Lehmann menemukan mineral merah-jingga dalam tambang Beryozovskoye di Pegunungan Ural yang ia namakan timbal merah Siberia. Meskipun disalahtafsirkan sebagai senyawa timbal dengan komponen selenium dan besi, mineral ini sebetulnya adalah krokoit (timbal kromat) dengan rumus PbCrO4.
- Pada tahun 1770, Peter Simon Pallas mengunjungi situs yang sama seperti yang dikunjungi oleh Lehmann dan meemukan mineral timbal merah yang memiliki manfaat sebagai pigmen dalam cat. Penggunaan timbal merah Siberia sebagai pigmen cat kemudian berkembang pesat. Pigmen kuning cerah yang dibuat dari krokoit juga menjadi populer.
- Pada tahun 1797, Louis Nicolas Vauquelin menerima sampel bijih krokoit. Ia membuat kromium trioksida (CrO3) dengan mencampur krokoit dengan asam klorida. Pada tahun 1798, Vauquelin menemukan bahwa ia dapat mengisolasi logam kromium dengan memanaskan oksidanya dalam oven batubara, sehingga ia dianugerahi sebagai penemu kromium. Vauquelin juga mampu mendeteksi jejak kromium dalam batu permata berharga, seperti rubi atau zamrud.
Selama tahun 1880an, kromium digunakan terutama sebagai komponen cat dan dalam garam penyamakan kulit. Pada mulanya, krokoit dari Rusia adalah sumber utama, tetapi pada tahun 1827, deposit kromit yang lebih besar ditemukan di dekat Baltimore, Amerika Serikat. Hal ini membuat Amerika Serikat sebagai produsen terbesar produk kromium sampai 1848 ketika deposit besar kromit ditemukan di dekat Bursa, Turki.
- Kromium juga dikenal karena kilaunya ketika dipoles. Ia digunakan sebagai penyalut untuk melindungi dan mempercantik bagian-bagian mobil, perlengkapan perpipaan, bagian-bagian furnitur, dan banyak barang lainnya, biasanya melalui aplikasi penyepuhan elektrik. Awal kromium digunakan untuk penyepuhan elektrik terjadi pada tahun 1848, tetapi penggunaan ini menjadi semakin meluas dengan perkembangan proses yang telah ditingkatkan pada tahun 1924.
Kromium trioksida
Adalah suatu senyawa anorganik dengan rumus kimia CrO3. Senyawa ini merupakan anhidrida asam dari asam kromat, dan terkadang dipasarkan dengan nama sejenis.
Senyawa ini adalah sebuah padatan berwarna merah gelap dalam kondisi anhidrat, berwarna jingga cerah saat basah dan larut dalam air bersamaan dengan hidrolisis. Jutaan kilogram senyawa ini diproduksi setiap tahun, terutama untuk galvanisasi. Kromium trioksida adalah oksidator kuat dan dicurigai sebagai suatu karsinogen (zat yang menyebabkan penyakit kanker.
Produksi, struktur dan reaksi Kromium trioksida
Kromium trioksida dihasilkan dengan memperlakukan natrium kromat atau natrium dikromat yang sesuai dengan asam sulfat:
- H2SO4 + Na2Cr2O7 → 2 CrO3 + Na2SO4 + H2O
Kira-kira 100M kg diproduksi setiap tahun oleh jalur reaksi ini atau yang serupa.
Padatan terdiri dari rantai atom kromium terkoordinasi secara tetrahedral yang memiliki simpul. Setiap pusat krom, oleh karenanya, berbagi dua pusat oksigen dengan tetangganya. Dua atom oksigen tidak dibagi, memberikan stoikiometri keseluruhan 1:3.
Struktur monomer CrO3 telah dikalkulasi menggunakan teori fungsi rapatan (DFT), dan diprediksi piramidal (kelompok titik C3v) dan bukan planar (kelompok titik D3h).
Kromium trioksida terurai di atas 197 °C melepaskan oksigen dan menghasilkan Cr2O3:
- 4 CrO3 → 2 Cr2O3 + 3 O2
Senyawa ini digunakan dalam sintesis organik sebagai oksidan, sering sebagai larutan dalam asam asetat,[8] atau aseton dalam kasus oksidasi Jones. Dalam oksidasi ini, Cr(VI) mengubah alkohol primer menjadi asam karboksilat yang sesuai dan alkohol sekunder menjadi keton. Reaksi ini dituliskan sebagai berikut:
- Alkohol primer
- 4 CrO3 + 3 RCH2OH + 12 H+ → 3 RCOOH + 4 Cr3+ + 9 H2O
- Alkohol sekunder
- 2 CrO3 + 3 R2CHOH + 6 H+ → 3 R2C=O + 2 Cr3+ + 6 H2O
Aplikasi Kromium trioksida
Kromium trioksida terutama digunakan dalam pelapisan krom. Hal ini biasanya digunakan dengan aditif yang mempengaruhi proses pelapisan tetapi tidak bereaksi dengan trioksida. Trioksida bereaksi dengan kadmium, seng, dan logam lainnya untuk menghasilkan film kromat pasif yang dapat menahan laju korosi. Senyawa ini juga digunakan dalam produksi rubi sintetik.
Larutan asam kromat juga digunakan dalam penerapan pelapisan anodik kepada aluminium, yang terutama digunakan dalam aplikasi ruang angkasa. Larutan asam kromat/ asam fosfat juga merupakan pelarut pelapis anodik dari semua jenis.
Keamanan Kromium trioksida
Kromium trioksida sangat beracun, korosif, dan bersifat karsinogenik. Senyawa ini merupakan contoh utama kromium heksavalensi, suatu kelompok zat kimia berbahaya bagi lingkungan. Turunan kromium(III) yang terkait tidak terlalu berbahaya; Dengan demikian, reduktor digunakan untuk menghancurkan sampel kromium(VI).
Kromium trioksida, sebagai oksidator kuat, akan menyulut bahan organik seperti alkohol ketika dalam kontak.
Tabel Periodik Kimia – Lengkap Dengan Daftar Unsur Kimia Berdasarkan Nama, Warna Dan Jenis
Tabel periodik adalah tampilan unsur-unsur kimia dalam bentuk tabel. Unsur-unsur tersebut disusun berdasarkan nomor atom (jumlah proton dalam inti atom), konfigurasi elektron dan keberulangan sifat kimia. Klik disini untuk membaca tabel periodik yang komplit.
Bacaan Lainnya
- Rumus Kimia Konsep Mol Dan Empiris Beserta Contoh Soal Dan Jawaban
- Manfaat Kalsium Untuk Tubuh Manusia
- Radiasi Sinar Cahaya | alfa (α), beta (β), gamma (γ), Radiasi X dan Neutron | Radiasi Pengion
- Indonesia Juga Memiliki 3 Reaktor Nuklir
- Reaktor Nuklir Alami Zaman Purba
- Awalnya, reaktor nuklir pertama digunakan untuk produksi plutonium sebagai bahan senjata nuklir
- Top 10 Sungai Terpanjang Di Dunia
- Tes Kepribadian Warna & Warna Mana Yang Anda Miliki? Hijau, Oranye, Biru, Emas
- Kepalan Tangan Menandakan Karakter Anda & Kepalan nomer berapa yang Anda miliki?
- Puncak Gunung Tertinggi Di Dunia dimana?
- TOP 10 Gempa Bumi Terdahsyat Di Dunia
- Apakah Matahari Berputar Mengelilingi Pada Dirinya Sendiri?
- Test IPA: Planet Apa Yang Terdekat Dengan Matahari?
- 10 Cara Belajar Pintar, Efektif, Cepat Dan Mudah Di Ingat – Untuk Ulangan & Ujian Pasti Sukses!
- TOP 10 Virus Paling Mematikan Manusia
Sumber bacaan: Wikipedia, Libretexts, Chem Guide, Britannica, Mindat.org
Pinter Pandai “Bersama-Sama Berbagi Ilmu”
Quiz | Matematika | IPA | Geografi & Sejarah | Info Unik | Lainnya | Business & Marketing

![{\displaystyle {\ce {{2[CrO4]^{2-}}+2H+<=>{[Cr2O7]^{2-}}+H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2a8a40be63cffe54c0cb6ff002ec2298dd50908c)