Litium
Litium adalah suatu unsur kimia dalam tabel periodik yang memiliki lambang Li dan nomor atom 3.
Litium adalah alkali pertama dalam tabel periodik. Di alam, mereka dalam bentuk campuran isotop Li 6 dan Li 7. Ini adalah logam padat paling ringan, titik lelehnya rendah, dan logamnya reaktif. Banyak sifat fisik dan kimianya lebih mirip dengan logam alkali tanah daripada kelompoknya sendiri.
Kegunaan utama litium dalam industri adalah dalam bentuk litium stearatum, sebagai pengental pelumas. Aplikasi penting lainnya dari senyawa litium adalah dalam tembikar, khususnya dalam pemolesan porselen; sebagai aditif untuk memperpanjang umur baterai alkaline; dalam las autogenous dan las kuningan. Litium adalah unsur yang cukup melimpah dan ada di kerak bumi di urutan 65 ppm (bagian per juta). Ini menempatkan lithium di bawah nikel, tembaga, tungsten, dan di atas ceryum dan timah, peringkat relatif terhadap kelimpahan.
Isotop Litium
Litium alami terdiri dari dua isotop stabil,6Li dan 7Li. Isotop 7Li lebih melimpah (kelimpahan alami 92,5%). Kedua isotop alami tersebut memiliki anomali energi ikatan nuklir per nukleon yang rendah (dibandingkan dengan unsur tetangganya pada tabel periodik, helium dan berilium); litium adalah satu-satunya unsur bernomor atom kecil yang bisa menghasilkan energi bersih melalui fisi nuklir.
Dua inti litium memiliki energi ikatan yang lebih rendah per nukleon daripada nukleon stabil lainnya kecuali deuterium dan helium-3. Alhasil, meski berat atomnya sangat ringan, litium kurang umum di Tata Surya dibandingkan 25 dari 32 unsur kimia pertama.
Tujuh radioisotop telah dikarakterisasi, yang paling stabil adalah 8Li dengan waktu paruh 838 ms dan 9Li dengan waktu paruh 178 ms. Semua isotop radioaktif yang tersisa memiliki waktu paruh yang lebih pendek daripada 8,6 ms. Isotop litium dengan umur terpendek adalah 4Li, yang meluruh melalui emisi proton dan memiliki waktu paruh 7,6 × 10−23 s.
Sejarah Litium
Petalit (LiAlSi4O10) ditemukan pada tahun 1800 oleh kimiawan sekaligus negarawan Brasil José Bonifácio de Andrada e Silva dalam sebuah tambang di pulau Utö, Swedia.
Namun, baru pada tahun 1817 Johan August Arfwedson, yang bekerja di laboratorium kimiawan Jöns Jakob Berzelius, mendeteksi keberadaan unsur baru ketika menganalisis bijih petalit. Unsur ini membentuk senyawa yang mirip dengan natrium dan kalium, meskipun karbonat dan hidroksidanya kurang larut dalam airdan lebih alkalis.
Berzelius memberi nama bahan alkalis tersebut dengan “lithion/lithina“, dari bahasa Yunani: λιθoς (ditransliterasikan sebagai lithos, yang berarti “batu”), untuk mencerminkan penemuannya dalam mineral padat, tidak seperti kalium yang ditemukan dalam abu tumbuhan, dan natrium yang diketahui memiliki kelimpahan tinggi dalam darah hewan. Ia menamakan logam di dalam bahan tersebut sebagai “litium“.
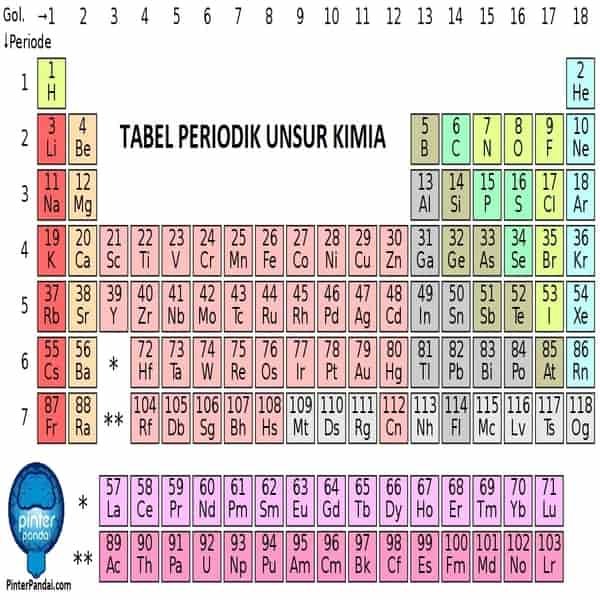
Tabel Periodik Kimia – Lengkap Dengan Daftar Unsur Kimia Berdasarkan Nama, Warna Dan Jenis
Tabel periodik adalah tampilan unsur-unsur kimia dalam bentuk tabel. Unsur-unsur tersebut disusun berdasarkan nomor atom (jumlah proton dalam inti atom), konfigurasi elektron dan keberulangan sifat kimia. Klik disini untuk membaca tabel periodik yang komplit.
Efek kesehatan dari lithium
Efek jika terkena litium:
- Mudah terbakar: Banyak reaksi dapat menyebabkan ledakan atau kebakaran. Menyebabkan asap yang mengiritasi dan beracun.
- Ledakan: Risiko kebakaran dan ledakan jika kontak dengan bahan yang mudah terbakar dan air.
- Inhalasi (terhirup): Sensasi terbakar, batuk, sesak napas. Kulit: Kemerahan, terbakar, nyeri. Mata : Kemerahan, nyeri.
- Tertelan: Kram dan sakit perut, sensasi terbakar, mual, muntah. Paparan: Substansi dapat diserap ke dalam tubuh melalui inhalasi dan konsumsi.
- Risiko penghirupan: Penguapan pada 20 derajat dapat diabaikan, namun konsentrasi partikel berbahaya di udara dapat dicapai dengan cepat.
- Efek paparan jangka pendek: Bahan ini korosif pada mata, kulit dan sistem pernapasan, menghirup bahan dapat menyebabkan edema paru. Gejala edema paru (kondisi gawat darurat yang disebabkan oleh penumpukan cairan di paru-paru yang terjadi secara tiba-tiba dan dapat mengganggu fungsi paru) seringkali hanya muncul setelah beberapa jam dan diperparah oleh aktivitas fisik. Namun, istirahat dan pengamatan medis sangat penting. Pemberian segera semprotan yang sesuai oleh dokter atau orang yang diberi wewenang olehnya harus dipertimbangkan.
- Efek Kimia: Pemanasan dapat menyebabkan ledakan hebat dan pembakaran. Substansi dapat menyala secara spontan pada kontak dengan udara. Dengan panas, asap beracun terbentuk. Reaksi hebat yang disebabkan oleh oksidan kuat, asam dan beberapa senyawa (hidrokarbon, halogen, beton, pasir, asbes) dapat menimbulkan bahaya kebakaran. Reaksi dengan air membentuk gas hidrogen yang sangat mudah terbakar dan asap korosif litium hidroksida.
Efek lithium pada lingkungan
Litium logam bereaksi dengan nitrogen, oksigen, dan uap air di udara. Oleh karena itu, permukaan litium menjadi campuran litium hidroksida (LiOH), litium karbonat (Li2CO3) dan litium nitrida (Li3N). Lithium hidroksida menghadirkan potensi bahaya yang signifikan karena sangat korosif. Pertimbangan khusus harus diberikan pada organisme akuatik.
Bacaan Lainnya
- Manfaat Emas Dalam Pengobatan Kesehatan Medis
- Rumus Kimia Konsep Mol Dan Empiris Beserta Contoh Soal Dan Jawaban
- Manfaat Kalsium Untuk Tubuh Manusia
- Indonesia Juga Memiliki 3 Reaktor Nuklir
- Reaktor Nuklir Alami Zaman Purba
- Awalnya, reaktor nuklir pertama digunakan untuk produksi plutonium sebagai bahan senjata nuklir
- Top 10 Sungai Terpanjang Di Dunia
- Tes Kepribadian Warna & Warna Mana Yang Anda Miliki? Hijau, Oranye, Biru, Emas
- Tibet Adalah Provinsi Cina – Sejarah Dan Budaya
- Puncak Gunung Tertinggi Di Dunia dimana?
- TOP 10 Gempa Bumi Terdahsyat Di Dunia
- Apakah Matahari Berputar Mengelilingi Pada Dirinya Sendiri?
- Test IPA: Planet Apa Yang Terdekat Dengan Matahari?
- 10 Cara Belajar Pintar, Efektif, Cepat Dan Mudah Di Ingat – Untuk Ulangan & Ujian Pasti Sukses!
- TOP 10 Virus Paling Mematikan Manusia
Unduh / Download Aplikasi HP Pinter Pandai
Respons “Ooo begitu ya…” akan lebih sering terdengar jika Anda mengunduh aplikasi kita!
Siapa bilang mau pintar harus bayar? Aplikasi Ilmu pengetahuan dan informasi yang membuat Anda menjadi lebih smart!
Sumber bacaan: Wikipedia
Pinter Pandai “Bersama-Sama Berbagi Ilmu”
Quiz | Matematika | IPA | Geografi & Sejarah | Info Unik | Lainnya | Business & Marketing