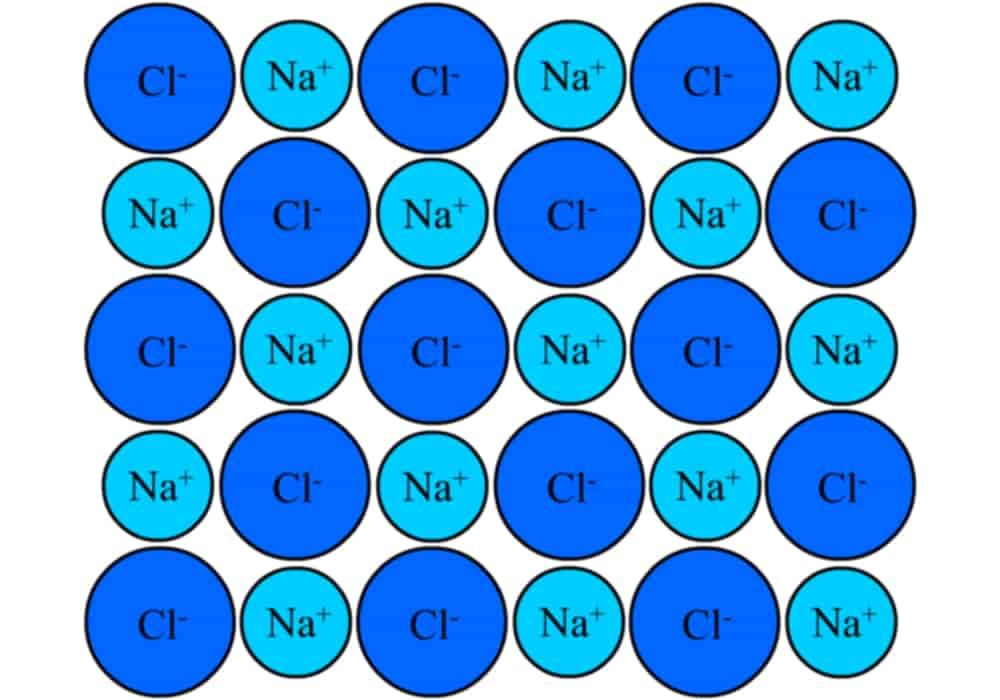
Garam NaCl
Dalam ilmu kimia, garam adalah senyawa ionik yang terdiri dari ion positif (kation) dan ion negatif (anion), sehingga membentuk senyawa netral (tanpa bermuatan).
Garam kimia terbentuk dari
Garam terbentuk dari hasil reaksi asam dan basa. Komponen kation dan anion ini dapat berupa senyawa anorganik seperti klorida (Cl−), dan bisa juga berupa senyawa organik seperti asetat (CH3COO−) dan ion monoatomik seperti fluorida (F−), serta ion poliatomik seperti sulfat (SO42−). Natrium klorida (NaCl), bahan utama garam dapur adalah suatu garam.
Garam yang terhidrolisa
Ada banyak macam-macam garam. Garam yang terhidrolisa dan membentuk ion hidroksida ketika dilarutkan dalam air maka dinamakan garam basa. Garam yang terhidrolisa dan membentuk ion hidronium di air disebut sebagai garam asam.
Garam netral adalah
Garam yang bukan garam asam maupun garam basa. Larutan Zwitterion mempunyai sebuah anionik dan kationik di tengah di molekul yang sama, tetapi tidak disebut sebagai garam. Contohnya adalah asam amino, metabolit, peptida, dan protein.
Larutan garam dalam air
Larutannya dalam air (Misalnya natrium klorida dalam air) merupakan larutan elektrolit, yaitu larutan yang dapat menghantarkan arus listrik. Cairan dalam tubuh makhluk hidup mengandung larutan garam, misalnya sitoplasma dan darah. Tapi, karena cairan dalam benda ini juga mengandung banyak ion-ion lainnya, maka tidak akan membentuk garam setelah airnya diuapkan.

Reaksi kimia garam
Garam dapat terbentuk dari 4 reaksi kimia. Reaksi kimia adalah sebagai berikut:
- Garam dari asam kuat dan basa kuat, garam ini bersifat netral (pH = 7). Contohnya adalah NaCl, KCl, K2SO4, Ca(NO3)2.
- Garam dari asam kuat dan basa lemah, garam ini bersifat asam (pH <7). Contohnya adalah Zn(ClO4)2, NH4Cl, AlCl3, Fe(NO3)2.
- Garam dari basa kuat dan asam lemah, garam ini bersifat basa (pH >7). Contohnya adalah Na2SO3, KCN, Na2CO3, (CH3COO)2Ca.
- Garam dari asam lemah dan basa lemah, sifat asam/basa bergantung pada nilai Ka dan Kb dari senyawa tersebut. Contoh Zn(NO2)2, CH3COONH4, Fe3(PO4)2.
Manfaat hidrolisis garam dalam kehidupan
Proses hidrolisis garam memiliki banyak manfaat dalam kehidupan sehari-hari. Contohnya adalah:
- Garam amonium nitral (NH4NO3) yang merupakan campuran dari basa lemah dan asam kuat. Sehingga garam ini bersifat asam. Amonium nitrat biasanya digunakan untuk alat kompres dingin.
- Monosadium Glutamat atau MSG (C5H8NO4Na) merupakan garam yang bersifat basa. MSG merupakan campuran dari asam lemah dan basa kuat. Garam ini biasa digunakan sebagai penyedap rasa pada makanan.
- Cangkang mollusca seperti cypraecassis rupa tersusun oleh kalsium karbonat (CaCO3). Garam ini bersifat basa.
- Kalium nitrat adalah garam yang bersifat netral. Garam ini terbentuk dari senyawa asam lemah dan basa lemah. Kalium nitrat biasa digunakan sebagai bahan pengawet dalam sosis (KNO3).
Ciri-ciri Garam Kimia
Warna
Garam dapat berwarna cerah dan transparan (contohnya natrium klorida), Buram, dan kadang juga berwarna metalik dan berkilau (Besi disulfida).
Garam kimia dapat berwarna macam-macam, seperti misalnya di bawah ini:
- kuning (natrium kromat),
- jingga (kalium dikromat),
- merah (kalium ferisianida),
- mauve (kobalt klorida heksahidrat),
- biru (tembaga sulfat pentahidrat, ferric hexacyanoferrate),
- ungu (kalium permanganat),
- hijau (nikel klorida heksahidrat),
- putih (natrium klorida/garam dapur),
- tidak berwarna (Magnesium Sulfate Heptahidrat) dan
- hitam (mangan dioksida).
Rasa
Di semua garam, ada 5 rasa berbeda, yaitu: asin (natrium klorida), manis (timbal (II) asetat, beracun kalau sampai tertelan), asam (kalium bitartrat), pahit (magnesium sulfat), dan gurih (monosodium glutamat).
Bau
Garam yang berasal dari asam kuat dan basa kuat (“garam kuat”) biasanya stabil dan tidak berbau, sedangkan garam yang terbentuk dari asam lemah maupun basa lemah (“garam lemah”) lebih berbau karena disebabkan oleh asam konjugasinya (contohnya asetat (asam asetat) pada (cuka) dan sianida seperti hidrogen sianida) atau bisa juga karena basa konjugasinya (contohnya garam amonium seperti amonia). Dekomposisi parsial ini bisa dipercepat dengan penambahan air, karena hidrolisis merupakan setengah bagian lain dari reaksi reversibel yang membentuk garam lemah.
Ion
Nama-nama garam diawali dengan nama ion kation (contohnya, natrium atau amonium) diikuti dengan nama ion anion (contohnya, klorida atau asetat).
Ion yang termasuk kation diantaranya:
- Amonium NH4+
- Kalsium Ca2+
- Besi Fe2+ and Fe3+
- Magnesium Mg2+
- Kalium K+
- Pyridinium C5H5NH+
- Quaternary ammonium NR4+
- Natrium Na+
Ion yang termasuk anion termasuk:
- Asetat CH3COO− (asam asetat)
- Karbonat CO32− (asam karbonat)
- Klorida Cl− (asam klorida)
- Sitrat HOC(COO−)(CH2COO−)2 (asam sitrat)
- Sianida C≡N− (asam sianida)
- Hidroksida OH− (air)
- Nitrat NO3− (asam nitrat)
- Nitrit NO2− (asam nitrit)
- Oksida O2− (air)
- Fosfat PO43− (asam fosfat)
- Sulfat SO42− (asam sulfat)
Pembentukan garam
Reaksi kimia untuk menghasilkan garam antara lain:
- Reaksi antara asam dan basa, misalnya asam klorida (HCl) + amoniak (NH3) → amonium klorida (NH4Cl).
- Reaksi antara logam dan asam kuat encer, misalnya Mg + 2 HCl → MgCl2 + H2. Keterangan: logam mulia umumnya tidak bereaksi dengan cara ini.
- Reaksi antara logam dan nonlogam, misalnya, Ca + Cl2 → CaCl2
- Reaksi antara basa dan oksida asam, misalnya, 2 NaOH + Cl2O → 2 NaClO + H2O
- Reaksi antara asam dengan oksida basa, misalnya, 2 HNO3 + Na2O → 2 NaNO3 + H2O
- Garam juga dapat dibentuk apabila 2 garam yang berbeda dicampur. Ion-ion mereka akan membentuk campuran baru, misalnya:
- Pb(NO3)2(aq) + Na2SO4(aq) → PbSO4(s) + 2 NaNO3(aq)
- Pb(NO3)2(aq) + Na2SO4(aq) → PbSO4(s) + 2 NaNO3(aq)
Soal dan Jawaban Garam Kimia
Dari garam berikut, yang mengalami hidrolisis total adalah…
A. NH4Br
B. K2CO3
C. BaCO
D. AlCl3
E. Al2(CO3)3
Jawaban : E
Pembahasan :
Karena garam terbentuk dari basa lemah ( Al(OH)₃ ) dan asam lemah ( H₂CO₃)
Garam berikut yang mengalami hidrolisis sebagian dan bersifat asam adalah..
A. (NH4)2CO3
B. CH3COONa
C. (NH4)2SO4
D. (CH3COO)2Ca
E. Na2SO4
Jawaban: C
Besarnya pH larutan 0,74 gram Ca(OH)2(Ar Ca = 40, O = 16, dan H = 1) dalam 500 mL larutan adalah…
A. 2 – log 4
B. 2 + log 4
C. 11 + log 4
D. 12 – log 4
E. 12 + log 4
Jawaban : E
Pembahasan :
Dik : massa Ca( OH )2 = 0,74 gram
V Ca( OH )2 = 500 mL
(Ar Ca = 40, O = 16, dan H = 1)
Dit : pH = …?
Dij :
M Ca(OH)2 = massa/mr x 1000/v
M Ca(OH)2 = 0,74/74 x 1000/500 = 0,02 M
Ca(OH)2 ==> Ca2+ + 2OH–
0,02M 0,02M 0,04M
pOH = -log[OH–]
= -log 0,04
= 2-log 4
pH = 14-(2-log 4)
= 12+log 4
Jenis Senyawa : Asam, Basa, Ionik, Garam, Oksida dan Organik

Klik disini untuk mengetahui jenis-jenis senyawa lainnya.
Bacaan Lainnya
- Rumus Kimia Konsep Mol Dan Empiris Beserta Contoh Soal Dan Jawaban
- Surfaktan Senyawa Organik – Penjelasan, Contoh Soal dan Jawaban
- Nama Obat dan Untuk Penyakit Apa ? – Daftar Nama Obat Esensial diterbitkan oleh Organisasi Kesehatan Dunia (WHO)
- Fraksi Mol Kimia”Xi” – Rumus, Penjelasan, Contoh Soal dan Jawaban
- Bagaimana Laut Mati / Dead Sea Mendapatkan Namanya? Mengapa Anda Dapat Mengapung Di Laut Mati?
- 10 Kegiatan Yang Akan Membantu Otak Anda Menjadi Tetap Muda Dan Tajam
- Jaringan tumbuhan yang berfungsi mengangankut air, dari akar ke daun adalah?
- Penyakit Alzheimer – Apa yang Terjadi di Otak?
- Apa Yang Terjadi Pada Saat Otak Kita Membeku?
- Sifat (perilaku) dapat dirubah. Tetapi watak (karakter) tidak dapat. Setuju ???
- Ternyata, jatuh cinta sebabkan perubahan kimiawi pada otak – hormon serotonin
- Cara Berciuman – Tips, Nasihat Dan Langkah Untuk Ciuman Pertama Yang Sempurna
- 7 Cara Untuk Menguji Apakah Dia, Adalah Teman Sejati Anda Atau Bukan BFF (Best Friend Forever)
- Kepalan Tangan Menandakan Karakter Anda – Kepalan nomer berapa yang Anda miliki?
Unduh / Download Aplikasi HP Pinter Pandai
Respons “Ooo begitu ya…” akan sering terdengar jika Anda memasang applikasi kita!
Siapa bilang mau pintar harus bayar? Aplikasi Ilmu pengetahuan dan informasi yang membuat Anda menjadi lebih smart!
Sumber bacaan: Britannica, Science Direct, LibreTexts, Elementalmatter