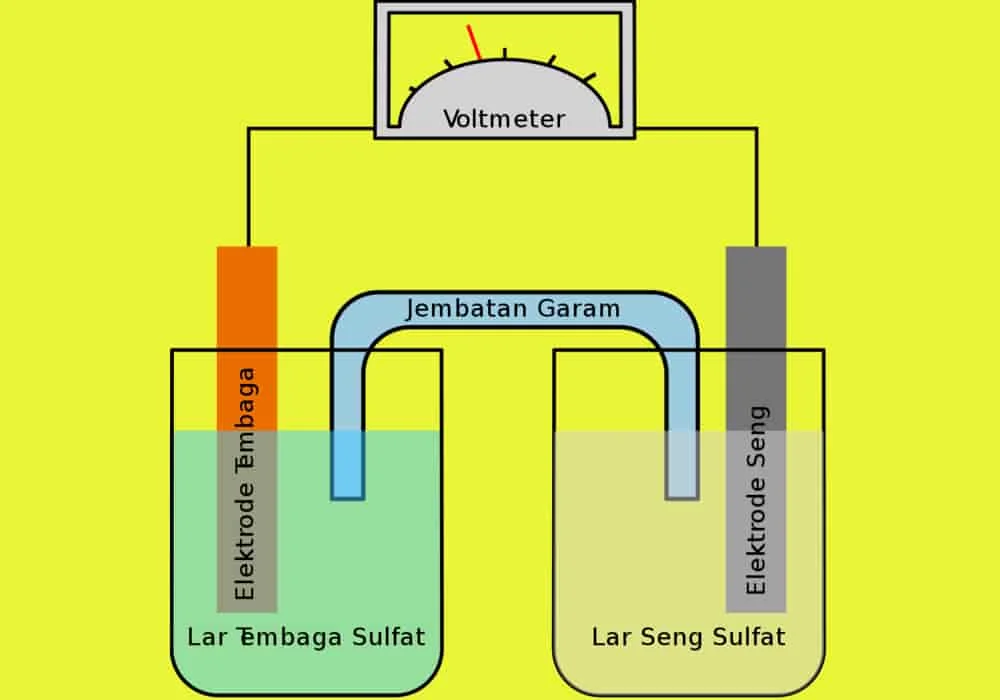
Elektrolit
Elektrolit adalah zat yang mengandung ion bebas dan berperilaku sebagai media konduktif listrik.
Pengertian dan perbedaan larutan elektrolit dan larutan nonelekrolit
Pengertian larutan
Larutan adalah campuran homogen antara zat terlarut dan pelarut. Zat terlarut adalah zat yang terdispersi ( tersebar secara merata ) dalam zat pelarut.
Zat terlarut mempunyai jumlah yang lebih sedikit dalam campuran. Ini biasa di sebut dengan solute. Sedangkan zat pelarut adalah zat yang mendispersi atau ( fase pendispersi ) komponen – komponen zat terlarut. Zat pelarut mempunyai jumlah yang lebih banyak dalam campuran. Zat pelarut di sebut solvent.
Pengertian larutan elektrolit dan larutan nonelektrolit
Larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik dengan memberikan gejala berupa menyalanya lampu pada alat uji atau timbulnya gelmbung gas dalam larutan .Larutan yang menunjukan gejala – gejala tersebut pada pengujian tergolong ke dalam larutan elektrolit.
Larutan nonelektrolit adalah larutan yang tidak dapat menghantarkan arus listrik dengan memberikan gejala berupa tidak ada gelembung dalam larutan atau lampu tidak menyala pada alat uji. Larutan yang menunjukan gejala – gejala tersebut pada pengujian tergolong ke dalam larutan nonelektrolit.
Jelaskan mengapa larutan elektrolit dapat menghantarkan arus listrik?
Larutan elektrolit dapat menghantarkan listrik karena mengandung ion-ion yang bergerak bebas. Larutan nonelektrolit tidak dapat menghantarkan arus listrik karena tidak ada ion-ion yang bergerak bebas.
Arus listrik dihasilkan oleh aliran muatan listrik. Arus listrik pada larutan dapat terjadi karena gerakan ion-ion. Adapun ion-ion tersebut merupakan partikel positif dan partikel negatif.
Senyawa pembentuk larutan elektrolit
Senyawa yang dalam larutannya dapat menghantarkan arus listrik berupa senyawa ion dan senyawa kovalen polar, karena senyawa-senyawa tersebut dapat terionisasi saat dilarutkan dalam air.
Senyawa ion
Senyawa ion tersusun dari ion-ion yang bentuknya padat dan kering. Ion-ion penyusun senyawa ion dalam pelarutnya akan bergerak bebas sehingga larutan ion dapat menghantarkan arus listrik.
Senyawa ion dalam bentuk kristal, ion-ionnya tidak dapat bergerak bebas sehingga tidak dapat menghantarkan arus listrik.
Contoh senyawa ion adalah NaCl, KCl, NaOH dan KOH.
Senyawa kovalen polar
Senyawa kovalen polar apabila dilarutkan dalam air, maka akan terurai menjadi ion-ion. Hal tersebut disebabkan oleh ikatan kovalen pada senyawa tersebut mudah putus dalam pelarut air dan menghasilkan ion-ion.
Contohnya asam klorida (HCl), Amonia (NH3).
Jenis – jenis larutan berdasarkan daya hantar listrik
Ciri-ciri larutan elektrolit kuat
- Larutan elektrolit mampu menghantarkan listrik.
- Terjadi proses ionisasi (ion-ion terurai)
- Larutan elektrolitnya kuat daya hantarnya.
- Terdapat gelembung gas
- Lampu menyala terang
Contoh larutan elektrolit kuat
|
Larutan elektrolit kuat adalah larutan yang banyak menghasilkan ion – ion karena terurai sempurna, maka harga derajat ionisasi (ά ) = 1. Banyak sedikit elektrolit menjadi ion dinyatakan dengan derajat ionisasi ( ά ) yaitu perbandingan jumlah zat yang menjadi ion dengan jumlah zat yang di hantarkan. Yang tergolong elektrolit kuat adalah :
- Asam – asam kuat
- Basa – basa kuat
- Garam – garam yang mudah larut
Ciri – ciri daya hantar listrik larutan elektrolit kuat yaitu lampu pijar akan menyala terang dan timbul gelembung – gelembung di sekitar elektrode. Larutan elektrolit kuat terbentuk dari terlarutnya senyawa elektrolit kuat dalam pelarut air.
Senyawa elektrolit kuat dalam air dapat terurai sempurna membentuk ion positif ( kation ) dan ion negatif (anion). Arus listrik merupakan arus electron.
Pada saat di lewatkan ke dalam larutan elektrolit kuat, electron tersebut dapat di hantarkan melalui ion – ion dalam larutan, seperti ddihantarkan oleh kabel. Akibatnya lampu pada alat uji elektrolit akan menyala. Elektrolit kuat terurai sempurna dalam larutan. Contoh : HCl, HBr, HI, HNO3, H2SO4, NaOH, KOH, dan NaCL.
Ciri-ciri Larutan Elektrolit Lemah
- Larutan elektrolitnya mampu menghantarkan listrik namun lemah
- Terjadi proses ionisasi (ion-ion terurai)
- Larutan elektrolitnya lemah daya hantarnya
- Terdapat gelembung gas
- Lampu menyala redup
Contoh Elektrolit Lemah
|
Larutan elektrolit lemah adalah larutan yang daya hantar listriknya lemah dengan harga derajat ionisasi sebesar 0 < ά > 1. Larutan elektrolit lemah mengandung zat yang hanya sebagian kecil menjadi ion – ion ketika larut dalam air. Yang tergolong elektrolit lemah adalah :
- Asam – asam lemah
- Garam – garam yang sukar larut
- Basa – basa lemah
Adapun larutan elektrolit yang tidak memberikan gejala lampu menyala, tetapi menimbulkan gas termasuk ke dalam larutan elektrolit lemah. Contohnya adalah larutan ammonia, larutan cuka dan larutan H2S.
Pengertian Larutan Non elektrolit
Larutan Nonelektrolit adalah larutan yang tidak dapat menghantarkan arus listrik, hal ini disebabkan karena larutan tidak dapat menghasilkan ion-ion. Berbeda dengan larutan elektrolit yang dapat mengahasilkan arus listrik, larutan non elektrolit sama sekali tidak dapat menghasilkan arus listrik dikarenakan tidak ada ion-ion yang terurai. Larutan non elektrolit.
Ciri-ciri Larutan Nonelektrolit
Berikut ini adalah ciri-ciri larutan nonelektrolit
- Tidak mengalami proses ionisasi
- Tidak dapat menghantarkan listrik
- Tidak terdapat gelembung gas
- Lampu tidak menyala
- Tidak mempunyai daya hantar
Contoh Larutan Nonelektrolit
|
Larutan non elektrolit
Larutan non elektrolit adalah larutan yang tidak dapat menghantarkan arus listrik karena zat terlarutnya di dalam pelarut tidak dapat menghasilkan ion – ion ( tidak mengion ). Yang tergolong jenis larutan ini adalah larutan urea, larutan sukrosa, larutan glukosa, alcohol dan lain – lain.
Tabel pengujian daya hantar listrik beberapa larutan
Larutan | Nyala Lampu | Gelembung Gas | ||
Ada | Tidak ada | Ada | Tidak Ada | |
| Larutan UreautanLarutan Anomia Laruran HCL Larutan Cuka Air aki Larutan alcohol Air laut Larutan H2S Air Kapur Larutan Glukosa | – – √ – √ – √ – √ – | √ √ – √ – √ – √ – √ | – √ √ √ √ – √ √ √ – | √ – – – – √ – – – √ |
Sifat Daya Hantar Listrik
Larutan tergolong ke dalam campuran homogen yang terdiri dari pelarut dan zat terlarut.
Pelarut -pelarut yang biasa digunakan adalah air. Sedangkan zat terlarut terdiri dari berbagai senyawa ion maupun kovalen. sifat daya hantar listrik zat yang terlarut dalam air dapat diketahui dengan uji nyala
Gambaran bentuk molekul elektrolit kuat, elektrolit lemah, dan nonelektrolit
| Jenis larutan | Sifat dan pengamatan lain | Contoh senyawa | Reaksi ionisasi |
|---|---|---|---|
| Elektrolit kuat | – Terionisasi sempurna – Menghantarkan arus listrik – Lampu menyala terang – Terdapat gelembung gas | NaCl, NaOH, H2SO4, HCl, dan KCl | NaCl —> Na+ + Cl– NaOH —> Na+ + OH– H2SO4 —> H+ + SO42- HCl —> H+ + Cl– KCl —> K+ + Cl– |
| Elektolit lemah | – Terionisasi sebagian – Menghantarkan arus listrik – Lampu menyala redup – Terdapat gelembung gas | CH3COOH, N4OH, HCN, dan Al(OH)3 | CH3COOH –> H+ + CH3COOH– HCN –> H+ + CN– Al(OH)3 –> Al3+ + OH– |
| Nonelektrolit | – Tidak terionisasi – Tidak menghantarkan arus listrik – Lampu tidak menyala – Tidak terdapat gelembung gas | C6H12O6 C12H22O11 CO(NH2)2 C2H5OH | C6H12O6 C12H22O11 CO(NH2)2 C2H5OH |
Elektrolit Dalam Tubuh – Berbagai Elektrolit: Manfaatnya dan Dampaknya pada Tubuh
Cairan di dalam tubuh kita terdiri dari banyak zat, salah satunya adalah elektrolit. Elektrolit ini memiliki peran penting dalam fungsi tubuh kita. Apa sajakah itu?
Di dalam darah, urine, jaringan tubuh, dan cairan tubuh kita lainnya terdapat zat yang bernama elektrolit. Elektrolit merupakan mineral yang membawa muatan listrik, contohnya kalsium, klorida, magnesium, fosfat, kalium (potasium), dan natrium (sodium).
Elektrolit masuk ke dalam tubuh melalui makanan dan minuman yang kita konsumsi. Zat kimia terkecil ini dibutuhkan oleh sel agar tubuh dapat berfungsi dengan baik dan normal.
Tiap elektrolit tersebut memainkan peran penting dan spesifik dalam tubuh kita. Namun terkadang, jumlah elektrolit dalam tubuh kita bisa berkurang atau berlebih. Hal tersebut terjadi karena jumlah air dalam tubuh kita berubah, bisa disebabkan oleh kekurangan cairan, mengonsumsi obat-obatan tertentu, atau menderita suatu penyakit. Yuk, kenali lebih dalam elektrolit-elektrolit yang ada dalam tubuh kita.
1. Sodium atau natrium
Sodium dibutuhkan tubuh untuk menjaga keseimbangan elektrolit, mengendalikan cairan dalam tubuh, memengaruhi tekanan darah, dan mengatur kontraksi otot dan fungsi saraf.
Berapa kadar sodium yang normal dalam darah?
Normalnya, kadar sodium dalam darah adalah 135-145 milimol/liter (mmol/L).
Kelebihan sodium, atau disebut juga hipernatremia, biasanya terjadi karena kurang minum air; dehidrasi parah akibat pengeluaran cairan berlebihan, misalnya akibat muntah yang berkepanjangan, diare, berkeringat, atau gangguan ginjal dan pernapasan; atau minum obat tertentu, contohnya kortikosteroid.
Kekurangan sodium, atau disebut juga hiponatremia
Sedangkan kekurangan sodium, atau disebut juga hiponatremia, dapat terjadi karena tubuh kehilangan banyak cairan melalui keringat atau luka bakar; muntah atau diare; terlalu banyak mengonsumsi cairan; kecanduan alkohol; mengonsumsi obat tertentu seperti obat diuretik, obat kejang; menderita gizi buruk, kelainan tiroid, kelainan hipotalamus, kelainan kelenjar adrenal, gagal ginjal, gagal jantung, gagal hati, atau mengalami penyakit yang mengganggu hormon antidiuretik (SIADH).
2. Kalsium
Kalsium merupakan mineral penting yang digunakan oleh tubuh untuk menstabilkan tekanan darah, mengendalikan kontraksi otot rangka, membangun tulang dan gigi yang kuat, berperan dalam penghantaran impuls saraf dan gerakan otot, serta membantu proses pembekuan darah.
Kelebihan kalsium disebut hiperkalsemia
Kondisi ini bisa terjadi apabila kita menderita hiperparatiroidisme; penyakit ginjal; gangguan tiroid; penyakit paru-paru seperti tuberkulosis atau sarkoidosis; beberapa jenis kanker; mengonsumsi suplemen vitamin D, kalsium, atau antasida secara berlebihan; atau minum obat litium dan teofilin.
Sedangkan kekurangan kalsium dapat disebabkan oleh gagal ginjal, hipoparatiroidisme, kekurangan vitamin D, pankreatitis, kanker prostat, gangguan pencernaan, dan obat tertentu termasuk heparin, obat osteoporosis, dan obat antiepilepsi.
3. Kalium atau potasium
Elektrolit yang satu ini berfungsi mengatur fungsi jantung dan tekanan darah, membantu hantaran rangsang saraf, kontraksi otot, kesehatan tulang, dan keseimbangan elektrolit; serta menjaga kesehatan saraf dan otot.
Dalam darah, jumlah kalium normal berada di kisaran 3,5-5 milimol/liter (mmol/L).
Kekurangan elektrolit ini disebut hipokalemia
Dapat terjadi pada orang yang memiliki gangguan makan; menderita diare, muntah parah, atau dehidrasi; minum obat pencahar, diuretik, atau kortikosteroid. Sedangkan hiperkalemia adalah kondisi di mana jumlah kalium dalam darah berlebih, biasanya disebabkan oleh dehidrasi parah, gagal ginjal, asidosis berat, minum obat penurun tekanan darah atau diuretik, atau karena kadar hormon kortisol dalam tubuh terlalu rendah.
4. Klorida
Klorida dibutuhkan untuk membantu keseimbangan elektrolit atau cairan tubuh, menjaga asam/basa (pH) tubuh, dan penting untuk pencernaan.
Tubuh dapat mengalami hipokloremia (kekurangan klorida)
Dapat berakibat gagal ginjal akut, terlalu banyak berkeringat, muntah, menderita gangguan makan, gangguan kelenjar adrenal, cystic fibrosis, atau karena disengat kalajengking.
Hiperkloremia adalah kelebihan klorida
Sedangkan hiperkloremia (kelebihan klorida) bisa terjadi akibat dehidrasi parah, gangguan kelenjar paratiroid, gagal ginjal, atau menjalani cuci darah.
Berapa kadar klorida yang normal itu?
Kadar klorida yang normal adalah 98-108 mmol/L.
5. Magnesium
Magnesium merupakan mineral elektrolit penting untuk produksi DNA dan RNA, meningkatkan sistem kekebalan tubuh, mengatur kadar glukosa darah, menjaga irama atau ritme jantung, serta berkontribusi pada fungsi saraf dan kontraksi otot. Magnesium juga dapat memperbaiki kualitas tidur pada penderita insomnia.
Kelebihan magnesium atau hipermagnesemia
Biasanya terjadi pada pasien penyakit Addison atau penderita penyakit ginjal stadium akhir. Dan tubuh dapat kekurangan magnesium (hipomagnesemia), biasanya karena gagal jantung, keringat berlebihan, diare kronis, gangguan pencernaan, kecanduan alkohol, atau minum obat seperti diuretik dan antibiotik.
6. Fosfat
Bersama dengan kalsium, fosfat bertugas menguatkan tulang dan gigi, serta membantu sel menghasilkan energi yang dibutuhkan untuk pertumbuhan dan perbaikan jaringan.
Kekurangan fosfat (hipofosfatemia)
Biasanya diakibatkan oleh kelenjar paratiroid yang terlalu aktif, kekurangan vitamin D, kelaparan, luka bakar parah, penyalahgunaan alkohol akut, atau obat-obatan tertentu.
Kelebihan fosfat (hiperfosfatemia)
Biasanya terjadi karena cedera otot parah, kelenjar paratiroid kurang aktif, gagal nafas, penyakit ginjal kronis, kadar kalsium rendah, sedang menjalani pengobatan kanker, dan minum obat pencahar yang mengandung fosfat secara berlebihan.
7. Bikarbonat
Mineral yang kadar normalnya 22-30 mmol/L ini berfungsi membantu tubuh mempertahankan pH yang sehat, mengatur kadar cairan tubuh dan mengatur fungsi jantung. Gangguan pada jumlah bikarbonat dalam darah bisa disebabkan oleh gangguan pernapasan, gagal ginjal, dan penyakit metabolik.
Gangguan elektrolit ringan bisa saja tidak menimbulkan gejala. Gejala akibat gangguan elektrolit seringkali muncul ketika sudah masuk dalam derajat yang lebih berat.
Gejala-gejala yang dapat terjadi gangguan elektrolit yaitu:
- mual muntah
- lemas
- bengkak pada tubuh
- detak jantung cepat (dada berdebar)
- keram atau kelemahan otot
- sakit kepala
- kejang
- penurunan kesadaran
- koma
Mengingat bahwa kondisi ini dapat disebabkan oleh berbagai faktor, penting untuk mendapat pemeriksaan dan penanganan yang dini oleh dokter. Jika Anda mengalami gejala-gejala gangguan elektrolit segeralah datangi unit gawat darurat terdekat untuk mendapatkan pengobatan tepat.
Penyebab ketidakseimbangan cairan elektrolit
Ketidakseimbangan elektrolit terjadi pada banyak kategori diagnostik yang berbeda.
Paparan lingkungan musim panas yang keras, dengan dehidrasi yang dihasilkan, hanyalah salah satu contoh dari akar penyebab potensial1; sayangnya, lebih banyak orang Australia yang terbunuh dari efek buruk gelombang panas daripada semua bahaya alam lainnya, digabung.2
Namun, ini hanya penyebab potensial. Ada ratusan akar penyebab ketidakseimbangan cairan dan elektrolit lainnya, termasuk:
- Pada anak-anak: penyebab utama dehidrasi dan ketidakseimbangan elektrolit pada anak-anak adalah gastroenteritis akut, suatu kelainan yang dapat diobati secara efektif dengan rehidrasi oral.
- Pada orang dewasa yang lebih tua: salah satu alasan utama populasi yang lebih tua berisiko tinggi mengalami dehidrasi dan ketidakseimbangan elektrolit adalah berkurangnya respons kehausan.
- Pada atlet: Ketidakseimbangan elektrolit selama berolahraga berasal dari berbagai sumber. Anehnya, otot-otot yang bekerja tidak kehilangan kandungan air selama latihan; alih-alih, otot mengalami dehidrasi selama periode pemulihan segera setelah latihan, mungkin dalam upaya mengembalikan volume plasma dan menstabilkan sistem kardiovaskular.
Contoh Soal dan Jawaban Elektrolit
1. Ion Ag+ dari larutan elektrolit AgCl dalam elekrolisis akan…
A. Melepas elektron ke anoda
B. Melepas elektron ke katoda
C. Menangkap elektron dari anoda
D. Menangkap ion negatif dari anoda
E. Menangkap elektron dari katoda
Jawab : e
Hantaran listrik pada larutan AgCl terjadi karena ion Ag+ menangkap elektron dari katoda.
2. Campuran antara air dan kopi bersifat sama dengan campuran antara air dan tanah…
A. Gula
B. Garam
C. Sirop
D. Tanah
E. Teh
Jawab : d
Kopi dan tanah sama-sama tidak larut dalam air.
3. Larutan yang mempunyai daya hantar listrik paling besar adalah…
A. HCl 0,1 M
B. C2H5OH 0,1 M
C. C2H5OH 0,1 M
D. HCOOH 0,1 M
E. K2SO4 0,1 M
Jawaban: a
Larutan HCl di dalam air terurai menjadi ion hidrogen bermuatan positif dan ion klorida bermuatan negatif.
4. Zat yang merupakan pelarut universal adalah…
A. Air
B. Eter
C. Alkohol
D. Benzena
E. Kloroform
Jawaban: a
Zat yang merupakan pelarut universal adalah air.
5. Tentukan jumlah ion elektrolit-elektrolit dari CaCO3 adalah…
A. 1
B. 3
C. 2
D. 4
E. 5
Pembahasan:
CaCO3 Ca2+ + CO32-
Jumlah Ca2+ adalah 1
Jumlah CO32- adalah 1
Jumlah ion adalah 2 (elektrolit biner).
Jadi, jawabannya adalah C
6. Larutan natrium hidroksida mempunyai derajat ionisasi 1, artinya…
A. Tidak Terionisasi
B. Terionisasi sebagian
C. Terionisasi Sempurna
D. Tetap Berbentuk Moleku NaOH
E. Sebagian Membentuk ion Na+ dan OH–
Jawaban : c
Karena elektrolit kuat dalam air dapat terionisasi sempurna dengan derajat ionisasi=1. Banyak-sedikitnya elektrolit yang mengion dinyatakan derajat ionisasi atau derajat disosasi (α), yaitu perbandingan antara jumlah zat yang mengion dengan jumlah zat yang dilarutkan. Jika semu zat yang dilarutkan mengion, maka derajat ionisasinya= 0. Jadi, Batas-batas nilai derajat ionisasi (α) adalah 0 ≤ α ≤ 1.
7. Larutan yang memiliki daya hantar listrik terbesar adalah…
A. H2SO4 2 M
B. HCl 2,5M
C. MgSO4 1 M
D. MgCl2 1 M
E. CuCl2 1,5 M
Pembahasan:
A. H2SO4→ 2 H+ + SO42-
Jumlah ion adalah 3.
Jumlah ion x M : 3 x 2 M = 6.
B. HCl→ H+ + Cl–
Jumlah ion adalah 2.
Jumlah ion x M : 2 x 2,5 M = 5.
C. MgSO4 → Mg2+ + SO42-
Jumlah ion adalah 2.
Jumlah ion x M : 2 x 2 M = 4.
D. MgCl2 à Mg2+ + 2 Cl–
Jumlah ion adalah 3.
Jumlah ion x M : 3 x 1 = 3.
E. CuCl2 → Cu2+ + 2 Cl–
Jumlah ion adalah 3.
Jumlah ion x M : 3 x 1,5 M = 4,5.
Jawaban: a
8. Gula pasir dan garam dapur masing-masing sebanyak satu sendok makan dimasukkan ke dalam segelas air lalu diaduk. Zat terlarut dalam larutan tersebut adalah…
A. Air
B. Gula pasir saja
C. Garam dapur saja
D. Gula pasir dan garam dapur
E. Larutan gula pasir dan garam dapur
Jawab : d
Gula pasir dan garam dapur sama-sama larut dalam air, sehingga disebut zat terlarut. Sedangkan air adalah zat pelarutnya.
9. Perhatikan beberapa larutan berikut!
a) H2C2O42M
b) Sr(OH)2 2M
c) K2So4 2M
d) CO(NH)2 2M
Pasangan larutan yang diperkirakan memiliki daya hantar listrik sama kuat adalah…
A. (1) dan (3)
B. (1) dan (4)
C. (2) dan (3)
D. (2) dan (4)
E. (3) dan (4)
Pembahasan :
Larutan yang mempunyai daya hantar listrik yang kuat adalah larutan yang senyawanya berikatan dengan ion.Ciri yang paling mudah untuk menentukan senyawa ionic adalah tersusun dari atom golongan logam dan non logam. Pada larutan di atas yang merupakan senyawa ion adalah nomor 2 dan 3 karena terdapat logam Sr ( stronsium ) dan K (kalium).
Jadi, pasangan larutan yang memiliki daya hantar listrik yang sama kuat adalah nomor 2 dan 3.
10. Larutan natrium hidroksida mempunyai derajat ionisasi 1, artinya…
A. Tidak terionisasi
B. Terionisasi sebagian
C. Terionisasi sempurna
D. Tetap berbentuk molekul NaOH
E. Sebagian membentuk ion Na+ dan OH–
Jawab : c
elektrolit kuat dalam air dapat terionisasi sempurna dengan derajat ionisasi=1.
11. Diketahui beberapa zat berikut:
1) Garam dapur
2) Gula pasir
3) Asam cuka
Berdasarkan sifat daya hantar listriknya, urutan larutan-larutan zat tersebut dari yang non elektolit ke yang lemah dan ke yang kuat ditunjukan oleh nomor…
A. 1,2, dan 3
B. 1,3, dan 2
C. 2,1, dan 3
D. 2,3, dan 1
E. 3,2, dan 1
Jawab : d
Gula pasir = non elektrolit
Asam cuka = elektrolit lemah
Garam dapur = elekrolit kuat
12. Gula pasir (sukrosa) di dalam air tetap sebagai molekul sukrosa (C12H22O11). Peristiwa ini menunjukan bahwa sukrosa bersifat…
A. Nonelektrolit
B. Elektrolit kuat
C. Elektrolit lemah
D. Menyalakan lampu
E. Menghantarkan listrik
Jawab : a
Gula pasir dalam air tidak terionisasi, sehingga tidak ada ion dalam larutan. Akibatnya, larutan gula tidak dapat menghantarkan listrik / nonelektrolit.
13. Senyawa di bawah ini yang merupakan elektrolit kuarterner adalah…
A. HCl
B. AlCl3
C. MgSO4
D. H2SO4
E. K2SO4
Pembahasan
A. HCl→H+ + Cl–
Jumlah H+ adalah 1
Jumlah Cl– adalah 1
Jumlah ion 2. Merupakan elektrolit biner.
B. AlCl3→Al3+ + 3 Cl–
Jumlah Al3+ adalah 1
Jumlah Cl– adalah 3
Jumlah ion 4. Merupakan elektrolit kuarterner.
C. MgSO4 → Mg2+ + SO42-
Jumlah Mg2+ adalah 1
Jumlah SO42- adalah 1
Jumlah ion 2. Merupakan elektrolit biner.
D. H2SO4 à 2 H+ + SO42-
Jumlah H+ adalah 2
Jumlah SO42- adalah 1
Jumlah ion 3. Merupakan elektrolit terner.
E. K2SO4→ 2 K+ + SO42-
Jumlah K+ adalah 2
Jumlah SO42- adalah 1
Jumlah ion 3. Merupakan elektrolit terner.
Jawaban: b.
14. Arus listrik dapat mengalir melalui elektrolit karena…
A. Munculnya gelembung gas
B. Lampu menyala saat listrik dialirkan
C. Arus mengalir dari kutub positif ke kutub negatif
D. Larutan elektrolit tetap terbentuk molekul
E. Terdapat ion-ion di dalam larutan yang dapat bergerak bebas
Jawab : c
Arus listrik dapat mengalir melalui elektrolit karena arus mengalir dari kutub positif ke kutub negatif.
15. Berikut ini berupa larutan
NaCl
CH3COOH
C2H5OH
H2SO4
HCN
Maka larutan yamg bersifat Elektrolit lemah adalah…
A. 2 dan 3
B. 1 dan 5
C. 3 dan 4
D. 1 dan 4
E. 2 dan 5
Jawaban:
E. 2 dan 5
Pembahasan:
Larutan elektrolit dapat menghantarkan listrik karena mengandung ion-ion yang bergerak.
Sifat-sifat larutan elektrolit lemah
- Terion sebagian ɑ < 1
- Daya hantar lemah
- Uji elektrolit: nyala redup atau tidak menyala tetapi ada gelembung
- Berupa senyawa kovalen polar yang terion sebagian
Contoh: CH3COOH, NH3, NH4OH, HCN, NH4Cl
16. Kristal senyawa ionik mempunyai ion-ion yang tidak dapat bergerak bebas. Ion-ion tersebut dapat bergerak bebas jika…
A. Didinginkan
B. Dikristalkan
C. Dilelehkan
D. Diendapkan
E. Dibekukan
Jawab : c
Karena dalam bentuk padatan, senyawa ion memiliki susunan mampat dan rapat sehingga tidak dapat bergerak bebas. Dengan demikian, padatan senyawa ion tidak dapat menghantarkan listrik. Senyawa ion dapat menghantarkan listrik jika dilelehkan atau dilarutkan dalam air. Hal ini terjadi karena dalam bentuk lelehan atau larutan, ion-ionnya dapat bergerak bebas.
17. HCl cair tidak dapat menghantarkan listrik, sedangkan larutan HCl dapat menghantarkan listrik. Berdasarkan fakta tersebut dapat disimpulkan bahwa…
A. Air menyebabkan perubahan pada kekuatan arus listrik
B. Arus listrik akan mengalir jika ada air sebagai mediumnya
C. HCl cair berikatan kovalen, sedangkan larutan HCl merupakan senyawa berikatan ion
D. HCl cair tidak terionisasi, tetapi jika dilarutkan ke dalam air akan terionisasi
E. Adanya air mengubah HCl yang semula berikatan ion menjadi berikatan kovalen
Jawab : d
HCl cair tidak terionisasi, tetapi jika dilarutkan ke dalam air akan terionisasi.
18. Data hasil pengamatan terhadap bebrapa larutan sebagai berikut:
| Larutan | Bola Lampu | Pengamatan Lain |
| 1 | Tidak menyala | Ada gelembung |
| 2 | Menyala | Ada gelembung |
| 3 | Tidak menyala | Tidak ada gelembung |
| 4 | Menyala | Ada gelembung |
| 5 | Tidak menyala | Tidak ada gelembung |
Larutan yang bersifat elektrolit ditunjukan oleh nomor…
A. 1,2 dan 3
B. 1,2 dan 4
C. 2,3 dan 4
D. 2,4 dan 5
E. 1,3 dan 5
Jawab : b
Larutan 1 bola lampu tidak menyala tetapi terdapat gelembung, berarti larutan tersebut elektrolit lemah. Sedangkan larutan 2 dan 4 bola lampu menyala dan terdapat gelembung, berarti kedua larutan tersebut elektrolit.
19. Larutan yang mempunyai daya hantar listrik paling besar adalah…
A. HCl 0,1 M
B. C2H5OH 0,1 M
C. NH4OH 0,1 M
D. HCOOH 0,1 M
E. K2SO4 0,1 M
Jawab : a
Larutan HCl di dalam air terurai menjadi ion hidrogen bermuatan positif dan ion klorida bermuatan negatif.
20. Berikut beberapa sifat Larutan
Terionisasi Sempurna
Menghantarkan arus listrik
Lampu menyala terang
Terdapat gelembung gas
20. Berdasarkan data diatas, dapat disimpulkan bahwa larutan tersebut bersifat…
A. Larutan Elektrolit kuat
B. Larutan elektrolit lemah
C. Larutan Non-elektrolit
D. Larutan Elektrolit
E. Larutan Buffer
Jawaban:
a. Larutan Elektrolit Kuat
Pembahasan:
Larutan Elektrolit Kuat adalah
Sifat-sifat Larutan Elektrolit Kuat
- Terionisasi sempurna
- Menghantarkan arus listrik
- Lampu menyala terang
- Terdapat gelembung gas
21. Elektrolit lemah memiliki daya hantar yang buruk , karena…
A. Terdapat gelembung gas.
B. Terionisasi sempurna
C. Terionisasi sebahagian
D. Lampu menyala terang
E. Menghantarkan arus listrik
Jawaban: C
Dalam elektrolit lemah terdapat gelembung gas , lampu menyala terang dan menghantarkan arus listrik tapi tidak terionisasi sempurna .
Daya hantarnya buruk dan memiliki derajat ionisasi (kemampuan mengurai menjadi ion2nya) kecil.Makin sedikit yang terionisasi, makin lemah elektrolit tersebut.
Dalam persamaan reaksi ionisasi elektrolit lemah ditandai dengan panah dua arah (bolak-balik) artinya reaksi berjadal dua arah…di satu sisi terjadi peruraian dan di sisi lain terbentuk kembali ke bentuk senyawa mula2.
22. Berikut merupakan ionisasi yang terjadi pada senyawa H2SO4. Ionisasi yang benar adalah…
A. H2SO4 → H2 + SO4
B. H2SO4 → H2 + SO42-
C. H2SO4 → 2H+ + SO42-
D. H2SO4 → 2H2 + SO4
E. H2SO4 → 2H2 + S + O2
Jawab : c
H2SO4 → 2H+ + SO42-
23. Larutan Elektrolit dapat menghantarkan arus listrik karena…
A. Di dalam suatu larutan tersebar molekul-molekul
B. Atom-atomnya terdistribusi merata
C. Terdapat ion-ion yang bergerak bebas
D. Molekul-molekunya meyerap electron
E. Molekul-molekulnya menyerap arus listrik
Jawaban : C.
Pada tahun 1887, seorang ilmuwan dari swedia yang bernama svante august Arrhenius mengemukakan sebuah teori yang dapat menjelaskan alasan mengapa larutan elektrolit dapat menghantarkan arus listrik yaitu karena didalam larutan elektrolit tersebut terdapat ion-ion yang dapat bergerak bebas. Sehingga ion-ion inilah yang dapat menghantarkan arus listrik.
24. Senyawa yang berikatan kovalen polar manakah yang dapat menghantarkan arus listrik?
A. HCl,
B. HBr
C. HI,
D. NH3
Jawab: a
Kalau kita perhatikan, bahwa hanya HCl yang merupakan senyawa kovalen di atom bersifat polar, pasangan elektron ikatan tertarik ke atom Cl yang lebih elektro negatif dibanding dengan atom H. Sehingga pada HCl, atom H lebih positif dan atom Cl lebih negative.
Jadi walaupun molekul HCl bukan senyawa ion, jika dilarutkan ke dalam air maka larutannya dapat menghantarkan arus listrik karena menghasilkan ion-ion yang bergerak bebas.Jadi ikatan kovalen polar di dalam air mampu terurai menjadi ion2 penyusunnya.
Jadi, senyawa HCl lah yang lebih berikatan kovalen polar yang dapat menghantarkan lostrik.
25. Gas yang dihasilkan saat penghantaran listrik dilakukan menggunakan larutan HCl adalah…
A. Klorin
B. Iodin
C. Bromin
D. Karbon monoksida
E. Karbon dioksida
Jawaban: a
Gas yang dihasilkan saat penghantaran listrik dilakukan menggunakan larutan HCl adalah gas klorin dan gas hidrogen.
26. Larutan yang menyebabkan lampu tidak menyala dan tidak muncul gelembung gas disekitar elektroda saat dilakukan uji dengan alat uji elektrolit adalah…
A. NaOH
B. H2SO4
C. HCOOH
D. CH3COOH
E. C2H5OH
Jawab : e
Larutan C2H5OH tidak terurai menjadi ion-ion saat dilarutkan sehingga tidak adapat menghantarkan listrik.
27. Di bawah ini yang dapat menghantarkan listrik paling baik badalah…
A. Larutan gula 0,1 M
B. Larutan asam asetat 0,1 M
C. Larutan asam asetat 1 M
D. Larutan NaCl 0,1 M
E. Larutan NaCl 1 M
Jawaban : E
NaCl adalah senyawa ion, jika dalam keadaan kristal sudah sebagai ion-ion, tetapi ion-ion itu terikat satu sama lain dengan rapat dan kuat, sehingga tidak bebas bergerak.
Jadi dalam keadaan kristal (padatan) senyawa ion tidak dapat menghantarkan listrik, tetapi jika garam yang berikatan ion tersebut dalam keadaan lelehan atau larutan, maka ion-ionnya akan bergerak bebas, sehingga dapat menghantarkan listrik.
Pada saat senyawa NaCl dilarutkan dalam air, ion-ion yang tersusun rapat dan terikat akan tertarik oleh molekul-molekul air dan air akan menyusup di sela-sela butir-butir ion tersebut (proses hidasi) yang akhirnya akan terlepas satu sama lain dan bergerak bebas dalam larutan.
Dan semakin besar koefisiennya maka semakin besar daya hantar listriknya.
Jadi jawaban nya adalah NaCl 1 M.
28. Salah satu faktor yang memengaruhi daya hantar listrik larutan elektrolit adalah…
A. Bola lampu
B. Sumber arus listrik
C. Volume larutan elektrolit
D. Konsentrasi larutan elektrolit
E. Jumlah air dalam larutan elektrolit
Jawab : d
Salah satu faktor yang memengaruhi daya hantar listrik larutan elektrolit adalah konsentrasi larutan elektrolit.
29. Anion yang terbentuk jika CuCl2 terionisasi di dalam air adalah…
A. Cu+
B. Cu2+
C. Cl–
D. Cl2+
E. Cl2-
Jawab : c
CuCl2 → Cu2+ + Cl–
Anion yang terbentuk adalah Cl–
30. Pada penghantaran listrik melalui larutan ZnBr2, ion Br– akan melepaskan elektron ke…
A. Anoda
B. Katoda
C. Anion
D. Kation
E. Elektroda
Jawab : a
Pada penghantaran listrik melalui larutan ZnBr2, ion Br– akan melepaskan elektron ke anoda dengan menghasilkan gas bromin.
31. Derajat ionisasi larutan gula dan larutan alkohol besarnya sama yaitu…
A. 0
B. 0,25
C. 0,5
D. 0,75
E. 1
Jawab : a
Larutan gula dan larutan alkohol mempunyai derajat ionisasi yaitu 0. Karena kedua larutan tersebut tidak terurai menjadi ion-ion saat dilarutkan dalam air.
32. Suatu larutan jika diuji dengan alat penguji elektrolit menunjukan adanta nyala lampu yang terang dan timbulnya gelembung gas. Larutan tersebut kemungkinan merupakan campuran…
A. Gula dan air
B. Urea dan air
C. Sirop dan air
D. Asam cuka dan air
E. Garam dapur dan air
Jawab : e
Garam dapur + air adalah campuran elektrolit kuat. Karena ion-ionnya terionisasi sempurna.
33. Manakah yang lebih kuat larutan elektrolit di bawah ini?
A. Hcl 1M
B. F2,
C. Cl2,
D. Br2
E. Hcl 3M
Jawab: e
Bila kita lihat HCl, F2, Cl2, Br2, adalah ikatan kovalen polar, namun hanya hcl lah yang dapat menghantarkan listrik , nah, kita lihat pula ada 2 Hcl berbeda konsentrasinya.bila sama jenisnya (sama2 elektrolit lemah atau sama2 elektrolit kuat) kekuatan larutan elektrolit ditentukan oleh konsentrasinya…semakin besar konsentrasi maka semakin besar kekuatannya. karena semakin banyak yang mengion.
Maka jawabannya adalah Hcl 3 M.
Bacaan Lainnya
- Redoks (Reduksi dan Oksidasi) Kimia Beserta Contoh Soal dan Jawaban
- Tabel Periodik Lengkap Dengan Daftar Unsur Kimia Berdasarkan Nama, Warna Dan Jenis
- Kesetimbangan Kimia – Reaksi Kimia – Termodinamika, Pengaruh Suhu, Zat Murni, Jenis Kesetimbangan
- Termokimia – Rumus, Penjelasan Beserta Contoh Soal dan Jawaban
- Biologi Sel
- Formula Satu – F1 adalah balapan mobil formula tempat duduk tunggal yang tertinggi
- Apakah Anda Memerlukan Asuransi Kendaraan? – Cara Memilih Asuransi Mobil Motor Untuk Pembeli Yang Pintar
- Apabila ada banjir sunami “Anda berada di dalam mobil”. Air mulai menggenang & naik dengan cepat. Apa yang akan Anda lakukan?
- Mobil Taksi Listrik Di New York City Mencapai 90% Pada Tahun 1899
- Bagaimana Cara Menjalankan Mobil Dengan Bahan Bakar Jagung?
- HKI 26 April: Hari Kekayaan Intelektual Sedunia (World Intellectual Property Day) – Penjelasan dan Contoh
- Website Live Streaming Online – TV Langsung Gratis Terbaik untuk Menonton TV Online
- Aturan Sepak Bola – Cara Bermain Sepak Bola
- Stem Cell “Sel Punca” – Regenerasi Sel, Pengertian, Manfaat, Aplikasi Pengobatan
- Nama Obat dan Untuk Penyakit Apa ? – Daftar Nama Obat Esensial diterbitkan oleh Organisasi Kesehatan Dunia (WHO)
- Apakah Produk Pembalut Wanita Aman?
- Penyakit Difteri Penularan, Penyebab, Gejala, Perawatan dan Pencegahan
- Penyakit Kusta Penularan, Penyebab, Gejala, Perawatan dan Pencegahan
- Sakit Punggung: Penyebab, gejala, pencegahan dan perawatan
- Penyebab Dan Cara Mengatasi Iritasi Atau Lecet Akibat Pembalut Wanita
- Sistem Reproduksi Manusia, Hewan dan Tumbuhan
- 10 Cara Belajar Pintar, Efektif, Cepat Dan Mudah Di Ingat – Untuk Ulangan & Ujian Pasti Sukses!
- TOP 10 Virus Paling Mematikan Manusia
- Cara Mengenal Karakter Orang Dari 5 Pertanyaan Berikut Ini
- Kepalan Tangan Menandakan Karakter Anda & Kepalan nomer berapa yang Anda miliki?
Unduh / Download Aplikasi HP Pinter Pandai
Respons “Ooo begitu ya…” akan lebih sering terdengar jika Anda mengunduh aplikasi kita!
Siapa bilang mau pintar harus bayar? Aplikasi Ilmu pengetahuan dan informasi yang membuat Anda menjadi lebih smart!