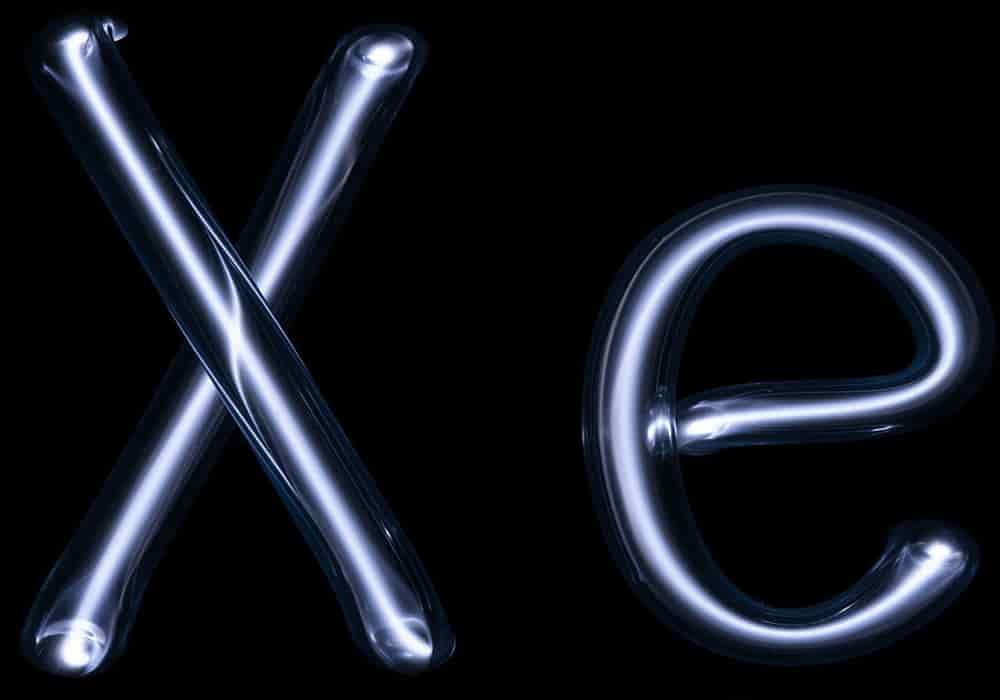Xenon
Xenon adalah suatu unsur kimia dalam tabel periodik yang memiliki lambang Xe dan nomor atom 54.
Bentuk Fisik
Berupa gas mulia, tak berwarna, tak berbau dan tidak ada rasanya.
Xenon diperoleh dari udara yang dicairkan. Xenon dipergunakan untuk mengisi lampu sorot, dan lampu berintensitas tinggi lainnya, mengisi bilik gelembung yang dipergunakan oleh ahli fisika untuk mempelajari partikel sub-atom.
Kegunaan Xenon Dalam Kehidupan Sehari-Hari
Xenon menghasilkan kilatan putih cemerlang cahaya ketika bersemangat elektrik dan secara luas digunakan dalam lampu strobo. Cahaya yang dipancarkan dari lampu xenon juga digunakan untuk membunuh bakteri dan laser daya ruby. Kegunaan lainnya pada Xenon adalah:
- Untuk pembuatan tabung electron.
- Untuk membuat lampu-lampu reklame yang member cahaya biru.
- Untuk pembiusan pasien pada saat pembedahan karena xenon bersifat anestetika (pemati rasa).
- Sebagai bahan baku pembuatan senyawa-senyawa xenon.
- Garam Perxenan (Na4XeO3) sebagai oksidator paling kuat.
- Untuk mengeluarkan cahaya pada kamera saat pemotretan (blitz).
- Pembuatan lampu untuk bakterisida (pembunuh bakteri).

Senyawa Xenon
Senyawa yang Mengandung Unsur Gas Mulia (Xenon) dengan Unsur Elektronegatif
| Senyawa | Rumus | Deskripsi |
| Difluorida | XeF2 | Kristal tak berwarna |
| Tetrafluorida | XeF4 | Kristal tak berwarna |
| Heksafluorida | XeF6 | Kristal tak berwarna |
| Trioksida | XeO3 | Kristal tak berwarna, eksplosif |
| Tetroksida | XeO4 | Gas tak berwarna, eksplosif |
Jika senyawa-senyawa fluorida dari xenon direaksikan dengan air akan terbentuk senyawa xenon yang lain. Persamaan kimianya:
2XeF2 + 2H2O → 2Xe + O2 + 4HF
XeF6 + H2O → XeOF4 + 2HF
Jika senyawa-senyawa fluorida dari xenon direaksikan dengan air akan terbentuk senyawa xenon yang lain. Persamaan kimianya:
2XeF2 + 2H2O → 2Xe + O2 + 4HF
XeF6 + H2O → XeOF4 + 2HF
Xenon trioksida, XeO3 merupakan oksida xenon yang paling utama.
XeO3 memiliki bentuk padat berwarna putih dan bersifat eksplosif. Akan tetapi, jika dilarutkan dalam air, sifat eksplosif XeO3 akan hilang sebab terbentuk senyawa asam ksenat, H2XeO4, yang bersifat oksidator kuat.
Xenon trioksida dapat juga bereaksi dengan suatu basa, seperti NaOH membentuk garam ksenat dan garam perksenat. Persamaan kimianya:
XeO3 + NaOH → NaHXeO4 (natrium ksenat)
4NaHXeO4 + 8NaOH → 3Na4XeO6 + Xe + 6H2O (natrium perksenat)

Sifat Kimia Golongan VIIIA / Gas Mulia
Pada tahun 1962, Neil Bartlett berhasil membuat sebuah senyawaan stabil yang dianggap sebagai XePtF6. Hal ini tentu menggemparkan, karena telah lama dikenal bahwa unsur golongan VIIIA bersifat inert.
Setelah ini, tidak lama kemudian ahli riset lainnya menunjukkan bahwa xenon dapat bereaksi langsung dengan fluor membentuk senyawaan biner seperti XeF2, XeF4, dan XeF6.
Bentuk senyawa-senyawa dari unsur xenon dengan bilangan oksidasinya adalah seperti berikut:
1. Bilangan Oksidasi +2
Kripton dan xenon dapat membentuk KrF2 dan XeF2 jika kedua unsur ini diradiasi dengan uap raksa dalam fluor. Xe (II) dapat bereaksi selanjutnya menjadi XeF4 jika suhu dinaikkan. Adapun XeF2 dapat terbentuk jika xenon padat direaksikan dengan difluoroksida pada suhu -120 °C.
Xe(s) + F2O2(g) → XeF2(s) + O2(g)
XeF2 dan KrF2 berbentuk molekul linier dengan hibdridisasi sp3d.
2. Bilangan Oksidasi + 4
Xenon(IV) fluorida dapat dibuat dengan memanaskan campuran xenon dan fluor dengan komposisi 1 : 5 pada tekanan 6 atm, dan menggunakan nikel sebagai katalis.
| Ni(s) | ||
| Xe(g) + 2F2(g) | → | XeF4(g) |
| 6 atm |
XeF4 mempunyai struktur bujur sangkar dengan hibridisasi d2sp3 pada suhu 400 °C.
3. Bilangan Oksidasi +6
Hanya xenon yang dapat membentuk XeF6. Senyawa ini dibuat dengan memanaskan campuran kedua unsur ini dengan komposisi Xe : F2 = 1 : 20 pada suhu 300 °C dan tekanan 50 atm.
| 50 atm | ||
| Xe(g) + 3F2(g) | → | XeF6(g) |
Xenon (VI) fluorida mempunyai bentuk oktahendral (distorted). Pada suhu kamar berbentuk kristal berwarna dan memiliki titik leleh 48 °C. Senyawa ini bereaksi dengan silika membentuk senyawa oksi gas mulia yang paling stabil.
SiO2(s) + 2XeF6(g) → SiF4(g) + 2XeOF4(l)
Pada suhu kamar XeOF4 berbentuk cairan tidak berwarna. XeF6 dapat mengalami hidrolisis membentuk xenon (VI) oksida, dengan reaksi seperti berikut.
XeF6(s) + 3H2O(l) → XeO3(aq) + 6HF(aq)
4. Bilangan Oksidasi +8
Xe (IV) dapat dioksidasi menjadi Xe (VIII) oleh ozon dalam larutan basa. Xe (VIII) hanya stabil dalam larutan. Selain senyawa xenon, telah berhasil dibuat kripton fluorida, KrF2 dan radon fluorida, RnF2.
Radon bereaksi spontan dengan fluor pada suhu kamar. Adapun kripton bereaksi dengan fluor hanya jika keduanya disinari atau melepaskan muatan listrik. Akan tetapi belum dilaporkan adanya senyawa helium, neon atau argon.
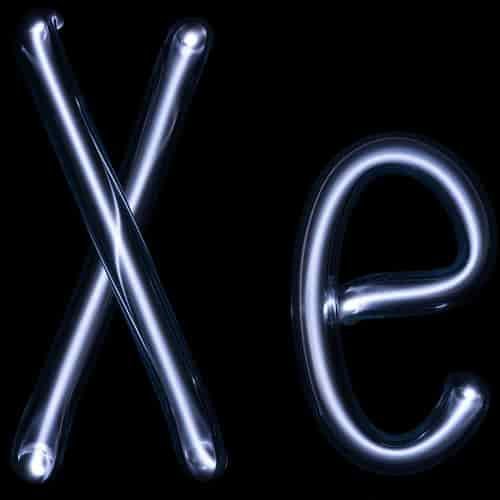
Isotop
Xenon alami terdiri dari delapan isotop stabil. Ini lebih dari unsur lain kecuali timah, yang memiliki sepuluh. Isotop 124Xe dan 134Xe diprediksi oleh teori untuk mengalami pembusukan beta ganda, namun hal ini tidak pernah diamati sehingga dianggap stabil.
Selain itu, lebih dari 40 isotop tidak stabil yang telah diteliti. Yang terpanjang tinggal dari isotop ini adalah 136Xe, yang mengalami pembusukan beta ganda dengan waktu paruh 2.11 × 1021 tahun. 129Xe diproduksi oleh peluruhan beta 129I, yang memiliki waktu paruh 16 juta tahun.
131mXe, 133Xe, 133mXe, and 135Xe adalah beberapa produk fisi 235U dan 239Pu, dan digunakan untuk mendeteksi dan memantau ledakan nuklir.
Isotop yang terstabil
| Isotop | Kelimpahan | Waktu paruh (t1/2) | Moda peluruhan | Produk | |
|---|---|---|---|---|---|
| 124Xe | 0.095% | 124Xe stabil dengan 70 neutron | |||
| 125Xe | syn | 16.9 jam | ε | 125I | |
| 126Xe | 0.089% | 126Xe stabil dengan 72 neutron | |||
| 127Xe | syn | 36.345 hr | ε | 127I | |
| 128Xe | 1.91% | 128Xe stabil dengan 74 neutron | |||
| 129Xe | 26.4% | 129Xe stabil dengan 75 neutron | |||
| 130Xe | 4.07% | 130Xe stabil dengan 76 neutron | |||
| 131Xe | 21.2% | 131Xe stabil dengan 77 neutron | |||
| 132Xe | 26.9% | 132Xe stabil dengan 78 neutron | |||
| 133Xe | syn | 5.247 hr | β− | 133Cs | |
| 134Xe | 10.4% | 134Xe stabil dengan 80 neutron | |||
| 135Xe | syn | 9.14 jam | β− | 135Cs | |
| 136Xe | 8.86% | 2.11×1021y[6] | β−β− | 136Ba | |

Sejarah Xenon
Xenon ditemukan oleh Sir William Ramsay, seorang ahli kimia Skotlandia, dan Morris M. Travers, seorang ahli kimia Inggris, pada 12 Juli 1898, tak lama setelah penemuan mereka dari unsur-unsur kripton dan neon. Seperti kripton dan neon, xenon ditemukan melalui studi udara cair. Atmosfer bumi adalah sekitar 0.0000087% xenon.
Tabel Periodik Kimia – Lengkap Dengan Daftar Unsur Kimia Berdasarkan Nama, Warna Dan Jenis
Tabel periodik adalah tampilan unsur-unsur kimia dalam bentuk tabel. Unsur-unsur tersebut disusun berdasarkan nomor atom (jumlah proton dalam inti atom), konfigurasi elektron dan keberulangan sifat kimia. Klik disini untuk membaca tabel periodik yang komplit.
Bacaan Lainnya
- Rumus Kimia Konsep Mol Dan Empiris Beserta Contoh Soal Dan Jawaban
- Manfaat Kalsium Untuk Tubuh Manusia
- Indonesia Juga Memiliki 3 Reaktor Nuklir
- Reaktor Nuklir Alami Zaman Purba
- Awalnya, reaktor nuklir pertama digunakan untuk produksi plutonium sebagai bahan senjata nuklir
- Top 10 Sungai Terpanjang Di Dunia
- Tes Kepribadian Warna & Warna Mana Yang Anda Miliki? Hijau, Oranye, Biru, Emas
- Kepalan Tangan Menandakan Karakter Anda & Kepalan nomer berapa yang Anda miliki?
- Tempat Wisata Yang Harus Dikunjungi Di Tokyo – Top 10 Obyek Wisata Yang Harus Anda Kunjungi
- Cara Membeli Tiket Pesawat Murah Secara Online Untuk Liburan Atau Bisnis
- Tibet Adalah Provinsi Cina – Sejarah Dan Budaya
- Puncak Gunung Tertinggi Di Dunia dimana?
- TOP 10 Gempa Bumi Terdahsyat Di Dunia
- Apakah Matahari Berputar Mengelilingi Pada Dirinya Sendiri?
- Test IPA: Planet Apa Yang Terdekat Dengan Matahari?
- 10 Cara Belajar Pintar, Efektif, Cepat Dan Mudah Di Ingat – Untuk Ulangan & Ujian Pasti Sukses!
- TOP 10 Virus Paling Mematikan Manusia
Unduh / Download Aplikasi HP Pinter Pandai
Respons “Ooo begitu ya…” akan lebih sering terdengar jika Anda mengunduh aplikasi kita!
Siapa bilang mau pintar harus bayar? Aplikasi Ilmu pengetahuan dan informasi yang membuat Anda menjadi lebih smart!
Sumber bacaan: Wikipedia, Web Elements
Pinter Pandai “Bersama-Sama Berbagi Ilmu”
Quiz | Matematika | IPA | Geografi & Sejarah | Info Unik | Lainnya | Business & Marketing