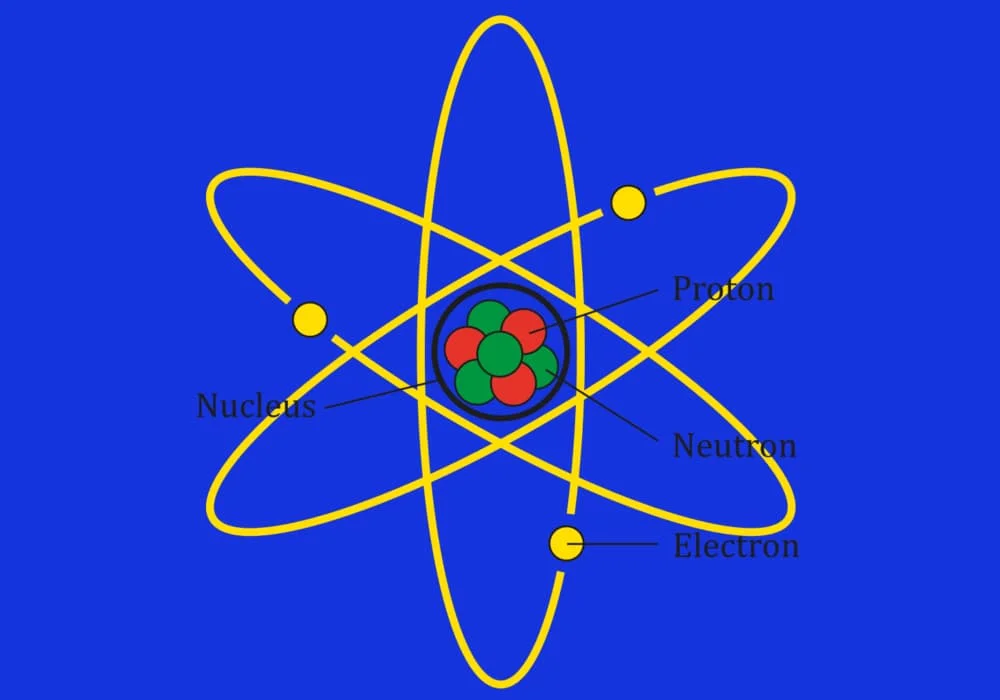
Atom
Atom adalah suatu satuan dasar materi, terdiri dari inti atom dan awan elektron yang bermuatan negatif dalam mengelilinginya.
Atom tersusun dari:
Partikel Dasar Atom (PROTON, NEUTRON DAN ELEKTRON)
Adanya partikel dasar ini tidak terlepas dari pengaruh gaya elektromagnetik yang mengikat partikel-pertikel ini.
Pengertian dari masing-masing partikel dasar suatu atom adalah:
Proton
Proton merupakan partikel dasar yang memiliki muatan positif (+1) dan memiliki diameter hanya 1/3 diameter electron. Akan tetapi, proton memiliki massa sekitar 1840 kali electron
Neutron
Neutron merupakan partikel dasar yang tidak memiliki muatan (netral), dan memiliki massa yang sama dengan gabungan antara massa proton dan massa electron
Elektron
Merupakan partikel dasar yang memiliki muatan negative (-1) dan memiliki massa paling ringan diantara partikel lainnya yang hanya 1/1840 kali massa proton atau neutron.
Contoh Atom
Berikut beberapa contoh-contohnya yang akan dijelaskan dalam tabel dibawah ini.
| No | Lambang | Nama |
| 1 | H | Hidrogen |
| 2 | Li | Litium |
| 3 | Na | Natrium |
| 4 | K | Kalium |
| 5 | Rb | Rubidium |
| 6 | Be | Berilium |
| 7 | Ca | Kalsium |
| 8 | Sr | Stronsium |
| 9 | B | Boron |
| 10 | Al | Aluminium |
| 11 | C | Karbon |
| 12 | Si | Silikon |
| 13 | Sn | Timah |
| 14 | Pb | Timbal |
| 15 | N | Nitrogen |
| 16 | P | Fosfor |
| 17 | O | Oksigen |
| 18 | S | Belerang |
| 19 | F | Fluor |
| 20 | Cl | Klor |
Penjelasan Inti Atom
Pusat dari atom disebut inti atom atau nukleus. Intinya terdiri dari proton dan neutron. Banyaknya proton dalam intinya disebut nomor atom, dan menentukan elemen dari suatu atom.
Ukuran intinya jauh lebih kecil dari ukurannya itu sendiri, dan hampir sebagian besar tersusun dari proton dan neutron, hampir sama sekali tidak ada sumbangan dari elektron.
Jumlah netron dalam intinya menentukan isotop elemen tersebut. Jumlah proton dan netron dalam intinya saling berhubungan; biasanya dalam jumlah yang sama, dalam nukleus besar ada beberapa netron lebih. Kedua jumlah tersebut menentukan jenis nukleus.
Proton dan netron memiliki masa yang hampir sama, dan jumlah dari kedua masa tersebut disebut nomor massa, dan beratnya hampir sama dengan massa atom (tiap isotop memiliki masa yang unik). Masa dari elektron sangat kecil dan tidak menyumbang banyak kepada masa atom.
Penjelasan Massa Atom
Massa atom (ma) dari suatu unsur kimia merupakan massa suatu atom pada keadaan diam, umumnya dinyatakan dalam satuan massa atom.
Sering disinonimkan dengan massa atom relatif, massa atom rata-rata, dan bobot atom. Walaupun demikian, terdapat sedikit perbedaan karena nilai-nilai tersebut dapat berupa rata-rata berbobot dari massa semua isotop unsur, atau massa dari satu isotop saja.
Untuk kasus suatu unsur yang hanya memiliki satu isotop dominan, nilai massa isotop yang paling melimpah tersebut dapat hampir sama dengan nilai bobot unsur tersebut.
Untuk unsur-unsur yang isotop umumnya lebih dari satu, perbedaan nilai massa dengan bobot atomnya dapat mencapai lebih dari setengah satuan massa (contohnya klorin). Massa suatu isotop yang langka dapat berbeda dari bobot standar sebesar beberapa satuan massa.
Massa relatif
- Massa relatif (Ar) adalah massa atom rata-rata relatif terhadap 1/12 dari massa atom karbon-12, dengan perata-rataan berdasarkan kelimpahan isotop. Ia bersinonim dengan bobot atom.
- Massa isotop relatif (Ar) adalah massa relatif suatu isotop yang diperbandingkan dengan karbon-12.
Partikel-Partikel Atom
Partikel Subatom
Dalam ilmu modern, atom sendiri tersusun atas beberapa partikel subatom. Partikel subatom ini meliputi proton, elektron dan neutron.
Inti
Terdiri dari proton dan neutron yang terikat di inti atom oleh suatu gaya elektromagnetik. Proton dan nutron itu disebut dengan nucleon (penyusun inti). Intinya memiliki diameter berkisar 10-15 nm. Atom dari unsur kimia yang sama memiliki jumlah proton yang sama juga. Suatu unsur dapat memiliki variasi jumlah neutron yang disebut dengan isotop.
Awan Elektron
Awan partikel merupakan suatu daerah dalam sumur potensi dimana tiap-tiap electron menghasilkan sejenis gelombang diam (gelombang yang tidak bergerak).
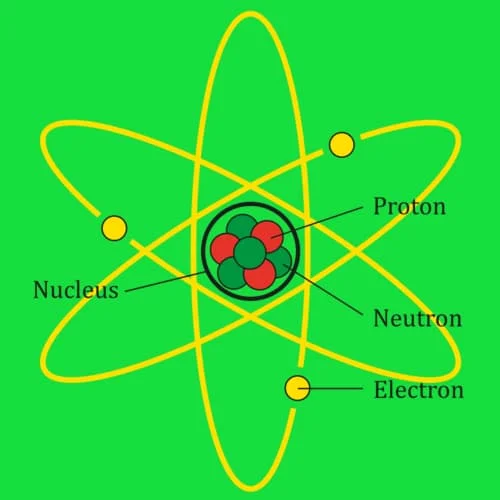
Model Atom
Berikut adalah model-modelnya: Dalton, Thompson, Rutherford dan Mekanika Kuantum:
1. Model Dalton
Menurut dari modelbya, mereka adalah bola pejal yang tidak memiliki muatan.
Yaitu kesatuan terkecil yang dapat dibagi-bagi lagi. Jika unsur kimia yang berbeda akan mempunyai jenisnya yang berbeda-beda juga.
Bunyi Dalton
- Merupakan bagian terkecil dari materi yang tidak dapat dibagi lagi
- Telah digambarkan sebagai pola pejal yang sangat kecil, sebuah unsur mempunyai atom yang identik dan berbeda untuk unsur yang berbeda.
- Bergabung membentuk senyawa dengan perbandingan sederhana dan bilangan bulat. Seperti air yang teridir dari hydrogen dan oksigen
- Reaksi kimia adalah penggabungan atau pemisahan atau penyusun dan kembali dari atom, sehingga ia tidak bisa di musnahkan atau dimusnahkan.
Kelebihan dari Teori Dalton
- Dapat menjelaskan hukum kombinasi kimia.
- Dalton merupakan orang pertama yang mengakui adanya perbedaan yang dapat diterapkan antara partikel dari suatu unsur atau atom dan dari molekul atau senyawa.
Kelemahan dari Teori Dalton
- Teori ini telah gagal menjelaskan adanya keberadaan alotrop. Perbedaan sifat arang, grafit serta berlian tidak mampu dijelaskan karea ketiganya terdiri dari atom yang sama (karbon).
- Dari unsur yang sama yaitu sama dalam segala hal. Pernyataan ini salah karena atom dari unsur yang berbeda disebut isotope. Contohnya, Klorin mempunyai dua isotope yang mempunyai massa yang mempunyai nomor massa 37 dan 35 satuan massa atom.
- Elemen yang berbeda. Hal ini terbukti salah dalam kasus tertentu.
- Unsur yang berbeda telah bergabung dalam rasio nomor sederhana keseluruhan untuk membentuk senyawa. Ini tidak terlihat pada senyawa kompleks misalnya gula C12H22O11 .
2. Model Thompson
Merupakan suatu bola padat yang bermuatan positif pada partikel negatif (elektron) yang tersebar didalamnya.
Kemudian, muatan positif dan negatif yang ada pada atom tersebut jumlahnya sama. Model ini telah dibuktikan pada penelitian Thomson yang memakai sinar tabung katoda.
Bunyi Teori J.J. Thomson
- Berupa bola bermuatan positif dengan adanya elektron bermuatan negatif yang berada disekelilingnya.
- Muatan positif dan negatif pada atom besarnya sama. Hal ini menjadikannya bermuatan netral. Suatu atom tidak memiliki muatan positif dan muatan negatif yang berlebihan.
Kelebihan Teori Model Thomson
- Dapat menerangkan adanya partikel yang lebih kecil dari atom yang disebut dengan subatomik.
- Dapat menerangkan sifat listrik-atom.
Kelemahan Teori Model Thomson
- Tidak dapat menerangkan fenomena penghaburan partikel alfa oleh selaput tipis emas yang dikemukakan Rutherford.
- Tidak mampu menjelaskan mengenai adanya intinya.
3. Model Rutherford
Model Rutherford telah dikemukakan oleh Ernest Rutherford di tahun 1911. Pada teori ini, setiap atomnya mempunyai kandungan inti yang bermuatan positif pada elektron yang mengelilingi didalamnya.
Massanya terpusat pada inti atomnya dan sebagian besar volume atom ini yaitu ruang hampa, Karena telah dibuktikan dari hasil percobaan penembakan logam dari sinar alpha, yang sudah dikenal sebagai Percobaan Geiger-Marsden.
Ciri-ciri Teori Rutherford
- Sebagian besar darinya merupakan permukaan kosong atau hampa.
- Memiliki intinyayang bermuatan positif yang merupakan pusat massanya.
- Elektron bergerak mengelilingi inti dengan kecepatan yang sangat tinggi.
- Sebagian besar partikel α (alpha) lewat tanpa mengalami pembelokkan/hambatan. Sebagian kecil dibelokkan, dan sedikit sekali yang dipantulkan.
- Awan elektron tidak mempengaruhi penyebaran partikel α (alfa).
Kelebihan Model Rutherford
- Mudah dipahami untuk menjelaskan strukturnya yang rumit.
- Dapat menjelaskan bentuk lintasan elektron yang mengelilingi intinya.
- Dapat menggambarkan gerak elektron disekitar inti.
Kelemahan Model Rutherford
- Menurut hukum fisika klasik, elektron yang bergerak mengelilingi inti memancarkan energi dalam bentuk gelombang elektromagnetik. Akibatnya, lama-kelamaan elektron itu akan kehabisan energi dan akhirnya menempel pada inti.
- Model rutherford ini belum mampu menjelaskan dimana letak elektron dan cara rotasinya terhadap intinya.
- Elektron memancarkan energi ketika bergerak, sehingga energinya menjadi tidak stabil.
- Tidak dapat menjelaskan spektrum garis pada atom hidrogen (H).
4. Model Bohr
Model Bohr dikemukakan oleh Niels Bohr dan Ernest Rutherford di tahun 1913. Bahwa mereka terdiri berdasarkan pada intinya yang mempunyai kandungan proton dan neutron kemudian dikelilingi oleh elektron yang berputar pada orbitnya (tingkat energi tertentu). Orbit dikenal juga sebagai kulit atom.
Kelebihan Teori Bohr
Terdiri dari beberapa kulit/subkulit untuk tempat berpindahnya elektron dan atom membentuk suatu orbit dimana intinya merupakan positif dan disekelilingnya terdapat elektron.
Kelemahan Teori Bohr
- Hanya mampu menjelaskan spektrum hidrogen tetapi tidak mampu menjelaskan spectrumnya yang lebih kompleks (dengan jumlah elektron yang lebih banyak).
- Orbit/kulit elektron mengelilingi intinya bukan berbentuk lingkaran melainkan berbentuk elips.
- Bohr menganggap elektron hanya sebagai partikel bukan sebagai partikel dan gelombang, sehingga kedudukan elektron dalam atom merupakan kebolehjadian.
5. Model Mekanika Kuantum
Terdiri berdasarkan pada intinya bermuatan positif dan awan-awan elektron yang mengelilinginya. Daerah tempat ditemukannya elektron yang diberi nama orbital. Menurut pada teori ini, ada empat jenis orbital yakni s, p, d, f.
Contoh Soal dan Jawaban tentang Atom
1. Konfigurasi elektron yang tepat untuk atom Cu dengan nomor atom 29 adalah…
Pembahasan :
Cu memiliki nomor atom 29, artinya Cu memiliki 29 elektron.
Konfigurasi elektron Cu
Perhatikan kulit valensinya yaitu
Ingat!!
Konfigurasi elektron yang stabil adalah yang orbitalnya terisi penuh atau setengah penuh elektron.
Pada kulit valensi Cu diatas, subkulit 4s-nya penuh terisi oleh elektron sedangkan subkulit 3d-nya tidak penuh ataupun setengah penuh ( subkuit d itu maksimum diisi oleh 10 elektron, setengah penuhnya adalah 5 elektron). Jadi konfigurasi ini kurang stabil, sehingga ia akan mengeksitasi(mentransfer) satu buah elektron dari subkulit 4s ke subkulit 3d, sehingga konfigurasi elektronnya menjadi:
Subkulit 4s-nya setengah penuh, sedangkan sub kulit 3d-nya penuh terisi oleh elektron. Hal ini lebih disukai oleh elektron karena bersifat lebih stabil.
Karena konfigurasi elektron diatas agak panjang, biasanya kita akan enyingkan dengan menggunakan konfigurasi atom golongan gas mulia. Untuk atom Cu, atom gas mulia yang mengdekati adalah Ar dengan nomor atom 18, sehingga konfigurasi elektronnya menjadi :
atau
Jawaban: B
2. Di antara unsur-unsur 20A, 16B, 14C, 10D dan 6E, pasangan unsur yang memiliki elektronvalensi sama adalah…
A dan C
A dan D
B dan C
B dan E
C dan E
Jawab : e
14C : 1s2 2s2 2p6 3s2 3p2
6E :1s2 2s2 2p2
Elektron valensinya sama-sama 4.
3. Pasangan unsur- unsur di bawah ini memiliki jumlah elektron valensi sama kecuali…
A. 6C dan 14Si
B. 11Na dan 19K
C. 12Mg dan 30Zn
D. 5B dan 21Sc
E. 7N dan 17Cl
Jawab : e
7N konfigurasi elektronnya 1s2 2s2 2p3 , elektron valensinya 5.
17Cl konfigurasi elektronnya 1s2 2s2 2p6 3s2 3p5 , elektron valensinya 7.
4. Ion di bawah ini yang tidak memiliki konfigurasi elektron sama seperti gas neon adalah…
Pembahasan :
Ne ( nomor atom 10)
Konfigurasi elektron =
Untuk melihat ion mana yang memiliki konfigurasi elektron yang sama dengan Ne, cukup lihat yang mempunayi jumlah elektron yang sama (isoelektronik) dengan Ne.
11 = 11 – 1 = 10 (sama dengan Ne)
12 = 12 – 2 = 10 ( sama dengan Ne)
13 = 13 – 3 = 10 ( sama dengan Ne)
8 = 8 + 2 = 10 ( sama dengan Ne)
16 = 16 + 1 = 17 (tidak sama dengan atom Ne)
5. Nomor unsur Cl = 17. Banyaknya elektron valensi yang terdapat dalam ion Cl–adalah
A. 2
B. 7
C. 8
D. 10
E. 12
Jawab : c
jumlah elektron Cl = no atom – (-1) = 18
ion Cl– : 1s2 2s2 2p6 3s2 3p6
6. Suatu atom mempunyai konfigurasi elektron  . Pernyataan yang benar adalah…
. Pernyataan yang benar adalah…
A. elektron valensi itu adalah 5
B. elektron valensi itu adalah 7
C. elektron valensi tersebut adalah 10
D. konfigurasi elektron
E. konfigurasi elektron
Pembahasan :
Konfigurasi elektron :
Atau disingkat :
Kulit valensi =
Jumlah elektron valensi = 2 + 5 = 7
Jawaban: B
7. Jumlah neutron dalam suatu atom dengan nomor atom 18 dan nomor massa 40 adalah…
A. 40
B. 30
C. 22
D. 20
E. 18
Jawaban: 22
Untuk menentukan neutron adalah nomor massa dikurangi nomor atom atau proton.
8. Reaksi kimia merupakan pemisahan, penggabungan, atau penyusunan kembali atom-atom, sehingga ia tidak bisa dibuat atau dimusnahkan. Teori ini dikemukakan oleh…
A. Dalton
B. Thomson
C. Niels Bohr
D. Rutherford
E. Max Planck
Jawaban: A
Teori ketidakpastian Heisenberg menyatakan bahwa kedudukan dan kecepatan gerak elektron tidak dapat ditentukan secara pasti, yang dapat ditentukan hanyalah kemungkinan terbesarnya atau probabilitasnya. Elektron dapat berpindah dari suatu lintasan ke lintasan yang lain sambil menyerap atau memancarkan energi.
9. Suatu unsur mempunyai konfigurasi elektron:

Yang merupakan kulit valensi unsur tersebut adalah…
A. 4s
B. 4p
C. 3d
D. 4s, 4p
E. 3d, 4s, 4p
Pembahasan :
Ujung konfigurasi =
Sub kulit p akan berpasangan dengan subkulit sdengan tingkat energi (Harga bilangan kuantum utama (n)) yang sama jadi kulit valensi atom diatas adalah =
Jawaban : D
10. Teori ini merupakan penyempurnaan teori Rutherford yang dikemukakan oleh…
A. Becquerel
B. Bohr
C. Dalton
D. Rontgen
E. Thomson
Jawab : b
Niels Bohr, seorang fisikawan, melakukan percobaan spektrum hidrogen untuk memperbaiki teori Rutherford. Hasil percoban Bohr menyimpulkan beberapa hal, diantaranya : Elektron dapat berpindah dari suatu lintasan ke lintasan yang lain sambil menyerap atau memancarkan energi.
11. Nomor atom unsur Cl = 17. Banyaknya elektron valensi yang terdapat dalam ion Cl– adalah…
A. 2
B. 7
C. 8
D. 10
E. 12
Jawaban: b
K L M
2 8 7
12. Atom-Natrium mempunyai nomor massa 23 dan nomor atom 11. Atom ini mempunyai…
A. 11 neutron
B. 11 proton
C. 12 elektron
D. 23 neutron
E. 23 elektron
Jawab : b
Nomornya sama dengan nomor proton.
13. Semua isotop dari suatu unsur mempunyai persamaan dalam hal…
A. Jumlah proton
B. Jumlah neutron
C. Juumlah nucleus
D. Jumlah proton dan neutron
E. Jumlah elektron dan neutron
Jawab : a
Isotop yaitu atom yang mempunyai nomor yang sama atau nomor proton yang sama, tetapi memiliki nomor massa yang berbeda.
14. Jika nomor massa unsur A adalah 30 dan A mempunyai elektron sebanyak 12 maka jumlah neutron unsur A adalah…
A. 16
B. 17
C. 18
D. 19
E. 20
Jawaban: c
Untuk menentukan neutron adalah nomor massa dikurangi nomor proton. Jumlah nomor proton sama dengan jumlah nomor elektron.
15. Apabila jumlah elektron valensi suatu unsur yang berada pada kulit ketiga adalah 7, nomor unsur tersebut adalah…
A. 8
B. 17
C. 18
D. 20
E. 25
Jawab : b
K L M
2 8 7
16. Diantara unsur di bawah ini yang mempunyai elektron valensi paling sedikit yaitu unsur dengan lambang…
A. 13X
B. 15X
C. 17X
D. 19X
E. 20X
Jawaban: d
Elektron valensinya adalah satu
19X : 1s2 2s2 2p6 3s2 3p6 4s1
17. Diketahui unsur unsur 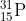 ,
,  ,
,  ,
, 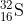 . Unsur unsur yang merupakan isoton adalah…
. Unsur unsur yang merupakan isoton adalah…
A. P dan Q
B. P dan S
C. Q dan R
D. R dan S
E. P dan R
Pembahasan :
Isoton = dua atom atau lebih yang mempunyai jumlah neutron sama
= jumlah n = 31 – 15 = 16
jumlah n = 30 – 15 = 15
jumlah n = 32 – 15 = 17
jumlah n = 32 – 16 = 16
Jadi yang isoton adalah P dan S
Jawaban : B
18. Suatu unsur mempunyai jumlah kulit 3 dan elektron valensi 6, unsur tersebut mempunyai nomor…
A. 14
C. 18
D. 20
B. 16
E. 22
Jawaban: d
1s2 2s2 2p6 3s2 3p4
jika dijumlah sama dengan 16.
19. Partikel dasar penyusun atom?
Adalah proton, neutron, dan elektron. Proton adalah partikel bermuatan listrik positif, elektron adalah partikel bermuatan listrik negatif, dan neutron adalah partikel yang tidak bermuatan.
20. Partikel penyusun inti atom?
Adalah proton dan neutron.
Inti atom tersusun oleh proton dan neutron, sedangkan elektron berada di luar inti.
21. Elektron adalah?
Elektron adalah partikel yang mengelilingi inti atom.
22. Atom unsur disebut netral karena?
Jumlah proton dan elektron sama. Sedangkan ion adalah atom yang bermuatan positif (kekurangan elektron) atau negatif (kelebihan elektron).
Bacaan Lainnya
- Reduktor dan Oksidator – Penjelasan, Contoh Soal dan Jawaban
- Tabel Alkana Alkena Alkuna – Senyawa Hidrokarbon – Rumus Molekul – Beserta Contoh Soal dan Jawaban
- Bilangan Oksidasi Kimia (Biloks) – Aturan Penentuan Biloks, Tabel, Contoh Soal dan Jawaban
- Pembakaran Kimia – Persamaan Kimia – Sempurna & Tak Sempurna dan Contoh Soal beserta Jawabannya
- Tabel Periodik Lengkap Dengan Daftar Unsur Kimia Berdasarkan Nama, Warna dan Jenis
- Rumus Kimia Konsep Mol dan Empiris Beserta Contoh Soal & Jawaban
- Unsur, Senyawa dan Campuran Kimia – Beserta Penjelasan & Rumus
- Rumus Fisika: Alat optik: Lup, Mikroskop, Teropong Bintang, Energi, Frekuensi, Gaya, Gerak, Getaran, Kalor, Massa jenis, Medan magnet, Mekanika fluida, Momen Inersia, Panjang gelombang, Pemuaian, Percepatan (akselerasi), Radioaktif, Rangkaian listrik, Relativitas, Tekanan, Usaha Termodinamika, Vektor
- Bagaimana Albert Einstein mendapatkan rumus E=mc² ?
Sumber bacaan: Chemistry Explained
Pinter Pandai “Bersama-Sama Berbagi Ilmu”
Quiz | Matematika | IPA | Geografi & Sejarah | Info Unik | Lainnya | Business & Marketing