Senyawa hidrokarbon adalah senyawa yang meliputi unsur hidrogen (H) dan karbon (C) dengan membentuk ikatan. Atom karbon merupakan salah satu atom yang cukup banyak berada di alam. Keberadaan atom karbon di alam berbentuk karbon, grafit, maupun intan. Dalam susunan tabel periodik unsur, atom karbon memiliki nomor atom 6. Banyaknya elektron valensi atom karbon adalah 4, sehingga salah satu cara agar berada dalam kondisi stabil adalah membuat ikatan dengan 4 atom hidrogen (H), yang kemudian disebut hidrokarbon. Senyawa hidrokarbon berupa senyawa kimia yang terdiri dari sebuah deret panjang rantai karbon. Rumus senyawa hidrokarbon dapat ditemui pada bensin, aspal, lilin, minyak pelumas (oli), solar, dan masih banyak lagi bahan alam yang terdiri darideret panjang sebuah rantai karbon.
Atom karbon memiliki nomor atom 6 dengan konfigurasi elektron 6C = 1s2 2s2 2p2. Karena memiliki 4 elektron pada kulit terluar, atom karbon dapat membentuk empat buah ikatan kovalen dengan atom – atom yang lain, baik ikatan kovalen tunggal, rangkap dua, atau rangkap tiga. Selain itu, atom – atom karbon juga membentuk rantai karbon.

Senyawa hidrokarbon dapat dibagi menjadi 2 yaitu senyawa hidrokarbon jenuh dan senyawa hidrokarbon tak jenuh. Senyawa hidrokarbon jenuh adalah senyawa hidrokarbon yang ikatan rantai karbonnya jenuh (tunggal), contohnya adalah senyawa – senyawa alkana. Sedangkan senyawa hidrokarbon tak jenuh adalah senyawa hidrokarbon yang mengandung ikatan kovalen rangkap 2 atau 3 pada rantai karbonnya, seperti pada senyawa alkena dan alkuna.
Apa itu senyawa alkana? Apa itu senyawa alkena? Apa itu senyawa alkuna? Simak masing – masing penjelasan senyawa hidrokarbon pada ulasan di bawah.
Senyawa Alkana
Alkana merupakan senyawa hidrokarbon yang ikatan rantai karbonnya tunggal. Rumus umum alkana dinyatakan dalam rumus umum CnH2n+2. Artinya, dalam senyawa alkana untuk sebanyak n atom C akan terdapat 2n + 2 atom H yang berikatan. Deret alkana untuk 1 atom C disebut metana. Untuk 2 atom C, deret alkana C2H6 memiliki nama etana. Nama – nama lain untuk senyawa alkana meliputi propana, butana, pentana, heksana, heptana, oktana, nonana, dan dekana.
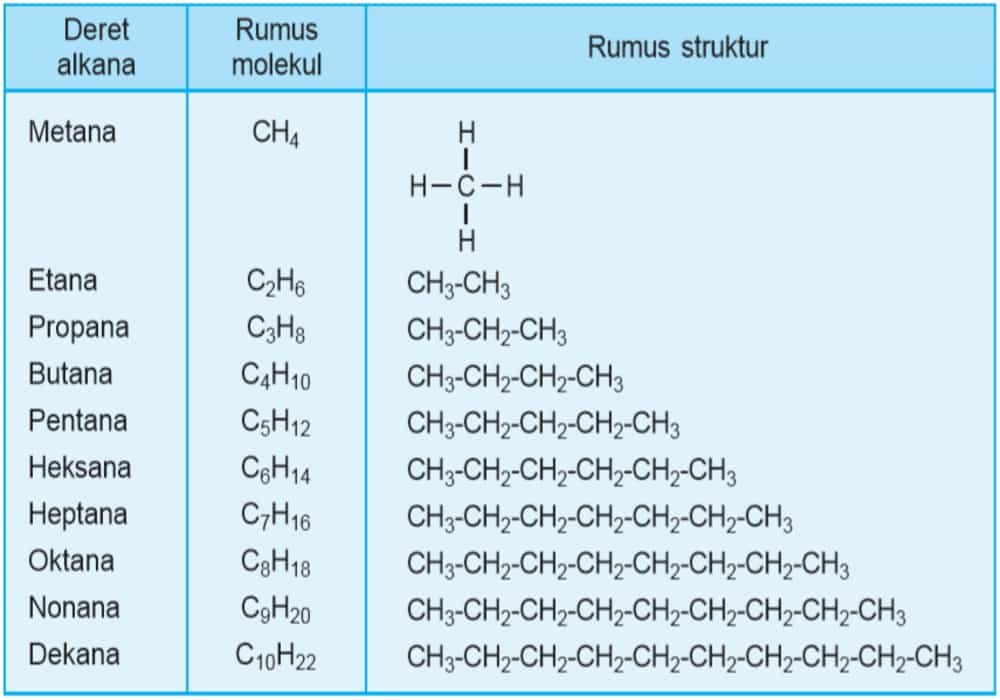
Rumus struktur dan rumus molekul deret alkana dapat dilihat melalui tabel homolog senyawa alkana berikut.
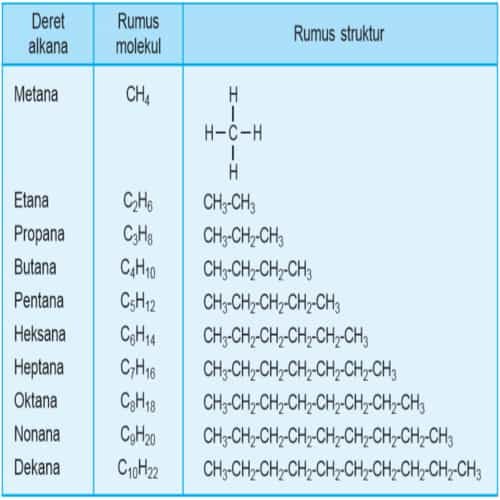
Dari metana ke etana mempunyai perbedaan – CH2 – begitu pula seterusnya. Deret senyawa karbon dengan gugus fungsi sama dengan selisih sama yaitu – CH2 – disebut deret homolog alkana.
Untuk memberi nama senyawa alkana, sobat idschool perlu memperhatikan aturan tata nama alkana yang telah disepakati secara internasional dalam konvensi IUPAC (International Union of Pure and Applied Chemistry).
Tata nama alkana berdasarkan IUPAC:
- Alkana rantai lurus diberi nama dengan awalan n (n = normal).Contoh:
- n – butana: CH3 – CH2 – CH2 – CH3
- n – pentana: CH3 – CH2 – CH2 – CH2 – CH3
- Alkana rantai lurus diberi nama dengan awalan n (n = normal).Contoh:
- Alkana rantai bercabang
- Rantai induk diambil rantai karbon terpanjang.
- Cabang merupakan gugus alkil, dengan rumus umum alkil adalah CnH2n + 1.
Nama alkil sama dengan nama alkana dengan jumlah atom C sama, hanya akhiran – ana diganti – il.- Jika hanya ada satu cabang maka rantai cabang diberi nomor sekecil mungkin.
- Jika alkil cabang lebih dari satu dan sejenis menggunakan awalan Yunani (di = 2, tri = 3, tetra = 4, dan seterusnya) dan jika berbeda jenis diurutkan sesuai alfabetis.
Contoh:
- 2 – metil butana

- 2 – metil butana
- 2,3 – dimetil butana

- 2,3 – dimetil butana
- 3 – etil – 2 – metil pentana

Bentuk struktur senyawa alkana serta jumlah atom C dan H yang berikatan akan membuat setiap senyawa alkana memiliki sifat yang berbeda. Simak – Sifat – sifat alkana yang dilihat dari sisi sifat fisis dan sifat kimia berikut.
Sifat – Sifat Senyawa Alkana:
Sifat Fisis:
- Alkana merupakan senyawa nonpolar.
- Bentuk senyawa alkana rantai lurus pada suhu kamar berbeda – beda:
C1 – C4 berwujud gas
C5 – C17 berwujud cair
C17 ke atas berwujud padat - Semakin banyak jumlah atom karbon, semakin tinggi titik didihnya.
- Adanya rantai cabang pada senyawa alkana menurunkan titik didihnya, semakin banyak cabang, titik didih makin rendah.
- Alkana mudah larut dalam pelarut organik (pelarut nonpolar seperti CCl4 atau sedikit polar seperti benzena) tetapi sukar larut dalam air.
- Alkana lebih ringan dari air.
Sifat Kimia:
- Alkana dan sikloalkana tidak reaktif, cukup stabil apabila dibandingkan dengan senyawa organik lainnya. Karena kurang reaktif, alkana kadang disebut paraffin (berasal dari bahasa Latin: parfum affin yang artinya “afinitas kecil sekali”).
- Alkana dapat bereaksi substitusi (reaksi penggantian atom/gugus atom dengan atom/gugus atom yang lain) dengan halogen misalnya Cl. Reaksi dengan halogen tersebut dinamakan reaksi halogenasi dan menghasilkan alkil halida.
Contoh:
CH4 (g) + Cl2 (g) → CH3Cl (g) + HCl (g) - Alkana dapat dibakar sempurna menghasilkan CO2 dan H2O. Pembakaran/oksidasi alkana bersifat eksotermik (menghasilkan kalor). Pembakaran alkana dapat berlangsung sempurna dan tidak sempurna.
Pembakaran sempurna menghasilkan gas CO2:
Reaksi pembakaran sempurna:
CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2O(g) + ESedangkan pembakaran tidak sempurna menghasilkan gas CO:
Reaksi pembakaran tak sempurna:
2 CH4 (g) + 3 O2 (g) → 2 CO (g) + 4 H2O (g) + E - Senyawa alkana rantai panjang dapat mengalami reaksi eliminasi. Reaksi eliminasi adalah reaksi penghilangan atom/gugus atom untuk memperoleh senyawa karbon lebih sederhana. Contoh pada reaksi eliminasi termal minyak bumi dan gas alam.
Senyawa Alkena
Senyawa hidrokarbon berikutnya adalah senyawa Alkena. Definisi senyawa Alkena adalah senyawa hidrokarbon yang mempunyai ikatan rangkap dua pada rantai karbonnya. Rumus umum alkena dinyatakan melalui rumus umum CnH2n. Artinya, pada senyawa alkena untuk setiap n atom C akan berikatan dengan 2n atom H.
Berikut ini rumus struktur, rumus molekul, dan nama senyawa deret alkena:

Seperti dengan senyawa alkana, untuk memberi nama senyawa alkena pun perlu mengikuti ketentuan aturan penamaan senyawa alkena. Pemberian nama senyawa alkena mengikuti ketentuan tata nama alkena berdasarkan konvensi penamaan IUPAC
Tata nama alkena menurut IUPAC:
- Rantai induk diambil rantai karbon terpanjang yang mengandung ikatan rangkap dua. Ikatan rangkap dua diberi nomor sekecil mungkin.
- Rantai cabang diberi nomor menyesuaikan nomor ikatan rangkap dua.Contoh:
- 2 – metil – 1 – butena

- 2,3 – di metil – 2 – butena

- 2 – metil – 1 – butena
Alkena juga memiliki sifat – sifat yang menjadi karakteristik dari senyawa alkana. Sifat – sifat alkena yang dapat dilihat berdasarkan sifat fisika dan kimia.
Sifat – sifat Alkena:
Sifat Fisika:
- Alkena memiliki sifat fisika yang hampir sama dengan alkana. Perbedaan antara senyawa alkana dan alkena terletak pada senyawa alkena yang dapat sedikit larut dalam air. Hal ini disebabkan oleh adanya ikatan rangkap yang membentuk ikatan S. Ikatan S tersebut akan ditarik oleh hidrogen dari air yang bermuatan positif sebagian.
Sifat Kimia:
- Oksidasi: sebagaimana hidrokarbon pada umumnya, pembakaran/ oksidasi alkena juga akan menghasilkan CO2 dan H2O.
Contoh: 2 C3H6 + 9 O2 → 6 CO2 + 6 H2O - Adisi H2: reaksi adisi merupakan reaksi pemutusan ikatan rangkap. Pada adisi alkena, ikatan rangkap berubah menjadi ikatan tunggal.
Contoh: CH2 = CH – CH3 + H2 → CH3 – CH2 – CH3 - Adisi halogen (F2, Br2, I2): reaksi adisi oleh halogen akan memutus rantai rangkap alkena membentuk alkana. Selanjutnya halogen tersebut akan menjadi cabang/substituen dari alkana yang terbentuk.
Reaksi umum: – CH = CH – + X2 → – CHX – CHX –
Contoh: CH2 = CH2 + Cl2 → CH2Cl – CH2Cl - Adisi Asam Halida: adisi dengan asam halida akan memutus ikatan rangkap pada alkena menjadi alkana dengan mengikuti aturan Markovnikof. Atom H dari asam halida akan terikat pada atom karbon dari alkena tidak simetris yang memiliki atom H paling banyak. Jika atom C yang berikatan rangkap memiliki jumlah H yang sama, halida akan terikat pada atom C yang paling panjang.
Senyawa Alkuna
Bahasan selanjutnya adalah senyawa hidrokarbon – Alkuna, merupakan senyawa hidrokarbon yang mempunyai ikatan rangkap tiga pada rantai karbonnya. Rumus umum alkuna dinyatakan dalam rumus umum CnH2n–2. Jadi, setiap n atom C akan berikatan dengan 2n – 2 atom H.
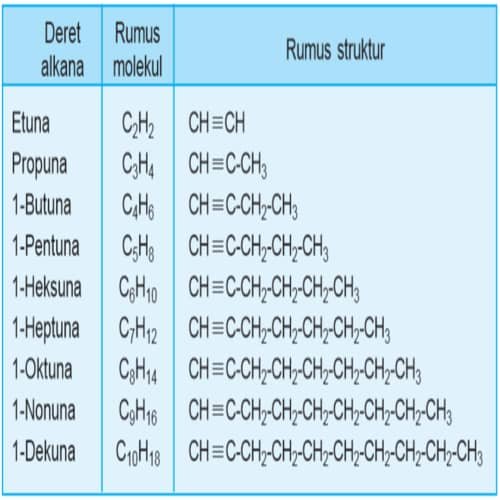
Ketentuan nama senyawa alkuna hampir sama dengan tata nama senyawa alkena. Perbedaanya terletak pada akhiran yang digunakan. Pada senyawa alkena, nama senyawa diakhiri dengan – ena. Untuk senyawa alkuna, nama senyawa berakhiran dengan – una. Berikut ini adalah ketentuan penamaan senyawa alkuna. Baca juga ? Daftar Alkana Rantai Lurus – Rumus Molekul – Beserta Nama Dagang/Populernya – Diurutkan Berdasarkan Jumlah Atom Karbon
Tata nama alkuna menurut IUPAC:
Rantai induk diambil rantai karbon terpanjang yang mengandung ikatan rangkap tiga. Ikatan rangkap tiga diberi nomor sekecil mungkin.
Rantai cabang diberi nomor menyesuaikan nomor ikatan rangkap tiga.
- 3 – metil – 1 – butana

- 3 – metil – 1 – butana
- 4,4 – dimetil – 2 – pentuna

- 4,4 – dimetil – 2 – pentuna
- 3 – etil – 4 – metil – 1 – pentuna

- 3 – etil – 4 – metil – 1 – pentuna
Karakteristik senyawa alkuna terdapat pada sifat – sifat alkuna yang dapat dilihat berdasarkan sifat fisika dan sifat kimia senyawa.
Sifat – sifat alkuna:
Sifat Fisika:
Sifat fisika alkuna sama dengan alkana dan alkena, senyawa alkuna juga sedikit larut dalam air.
Sifat Kimia:
Oksidasi: sebagaimana hidrokarbon pada umumnya, alkuna jika dibakar sempurna akan menghasilkan CO2 dan H2O.
Contoh: C3H4 + 4 O2 → 3 CO2 + 2 H2O
Adisi H2: Alkuna mengalami dua kali adisi oleh H2 untuk menghasilkan alkana.
Contoh:
CH ![]() C – CH3 + H2 → CH2 = CH – CH3 + H2 → CH3 – CH2 – CH3
C – CH3 + H2 → CH2 = CH – CH3 + H2 → CH3 – CH2 – CH3
Adisi Halogen (X2 = F2, Cl2, Br2, I2):
Contoh:

Adisi Asam Halida (HX = HF, HCl, HBr, HI): Adisi alkuna oleh asam halida mengikuti aturan Markovnikov sebagaimana pada alkena.
Contoh:
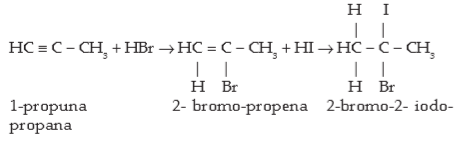
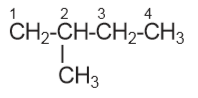
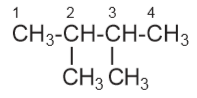


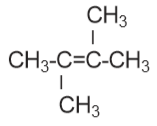

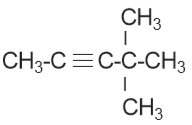
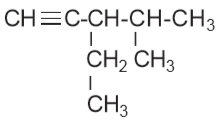
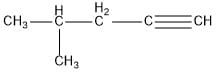

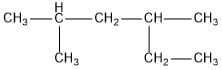 adalah…
adalah…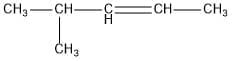
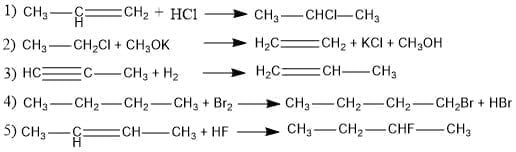 Jenis reaksi eliminasi ditunjukkan oleh persamaan reaksi angka…
Jenis reaksi eliminasi ditunjukkan oleh persamaan reaksi angka…