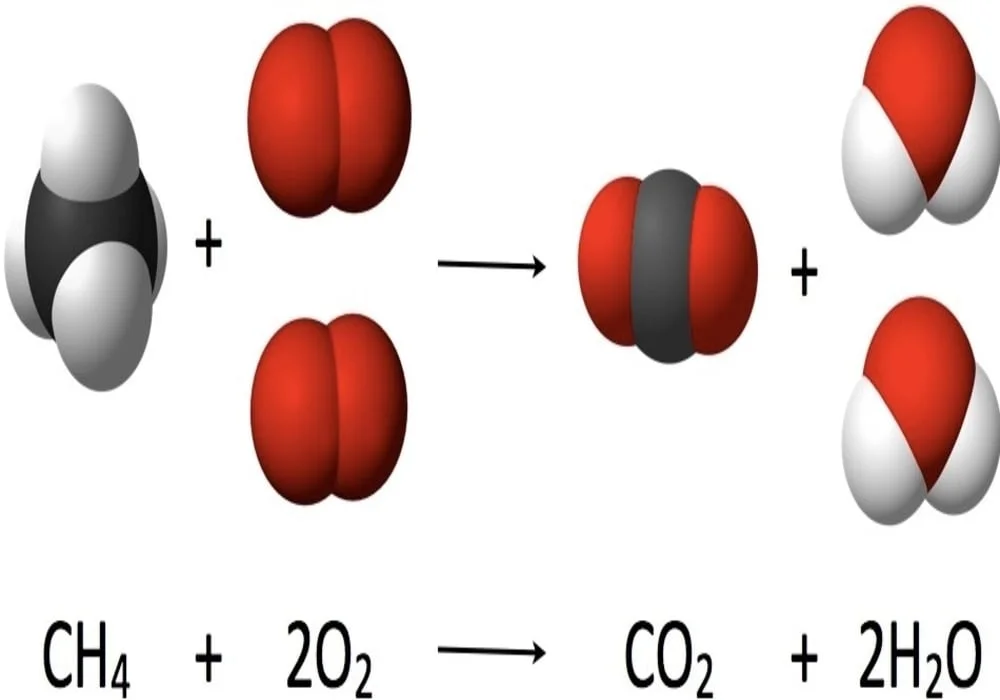
Penjelasan Stoikiometri
Dalam ilmu kimia, stoikiometri (kadang disebut stoikiometri reaksi untuk membedakannya dari stoikiometri komposisi) adalah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia). Kata ini berasal dari bahasa Yunani stoikheion (elemen) dan metriā (ukuran).
Stoikiometri didasarkan pada hukum-hukum dasar kimia, yaitu hukum kekekalan massa, hukum perbandingan tetap, dan hukum perbandingan berganda.
Contoh:
Stoikiometri gas adalah suatu bentuk khusus, di mana reaktan dan produknya seluruhnya berupa gas.
Dalam kasus ini, koefisien zat (yang menyatakan perbandingan mol dalam stoikiometri reaksi) juga sekaligus menyatakan perbandingan volume antara zat-zat yang terlibat.
Jenis Stoikiometri
Stoikiometri Reaksi
Stoikiometri sering sekali digunakan untuk menyeimbangkan persamaan kimia yang dapat ditemukan pada stoikiometri reaksi. hal Ini menggambarkan hubungan kuantitatif antara zat karena berpartisipasi dalam reaksi kimia.
Di dalam contoh di atas, nitrogen dan hidrogen bereaksi untuk membentuk amonia, reaksi stoikiometri menggambarkan rasio molekul nitrogen, hidrogen dan amonia 1: 3: 2.
Stoikiometri Komposisi
Hal ini menjelaskan kuantitatif (massa) hubungan antara unsur-unsur dalam senyawa. contohnya, stoikiometri komposisi menggambarkan (massa) nitrogen dengan hidrogen yang bergabung menjadi amonia kompleks. yaitu 1 (satu) mol nitrogen dan 3 (tiga) mol hidrogen dalam setiap 2 mol amonia.
Mol ialah satuan yang dipakai dalam kimia untuk jumlah zat.
Stoikiometri Gas
Ialah Jenis stoikiometri yang berkaitan dengan reaksi yang melibatkan gas, di mana gas berada pada suhu, tekanan dan volume yang di kenal dan dianggap gas ideal.
Untuk gas, perbandingan volume idealnya sama dengan hukum gas ideal, akan tetapi rasio massa reaksi tunggal harus dihitung dari massa molekul reaktan dan produk, di mana massa molekul ialah massa 1 (satu) molekul zat. Gas ideal ialah gas teoretis yang terdiri dari satu set partikel dan yang bergerak acak, tanpa-berinteraksi yang mematuhi hukum gas ideal.
Hukum gas ideal ialah persamaan keadaan gas ideal. Persamaan hukum gas ideal adalah PV = nRT, di mana P adalah tekanan, dan V adalah volume dan T adalah temperatur absolut,sedangkan n adalah mol gas dan R adalah konstanta gas universal.

Contoh Soal dan Jawaban Stoikiometri
1. Sebuah senyawa Propana terbakar dengan persamaan reaksi sebagai berikut ini:
C3H8+O2⟶H2O+CO2
Jika 200 g propana yang terbakar, maka hitunglah berapa jumlah H2O yang harusnya terbentuk?
Jawaban:
Setarakan persamaan reaksinya!
Hitung mol C3H8!
mol=m/Mr -> mol= 200 g/ 44 g/mol ->mol= 4.54 mol
Hitung rasio H2O : C3H8 -> 4:1
Hitung mol H2O dengan perbandingan contohnya 1
mol H2O : 4 = mol C3H8 : 1
-> mol H2O : 4 = 4.54 mol : 1
-> mol H2O = 4.54 x 4= 18.18 mol
Konversi dari mol ke gram.
mol = m/Mr
m = mol x Mr
m = 18.18 mol x 18
m = 327.27 gram
2. Jika di dalam senyawa FeS perbandingan massa Fe : S = 7:4 , maka untuk menghasilkan 4,4 gram senyawa FeS diperlukan Fe dan S berturut-turut sebanyak…
a. 4,0 gram dan 0,4 gram
b. 3,7 gram dan 0,7 gram
c. 2,8 gram dan 1,6 gram
d. 3,0 gram dan 1,4 gram
e. 3,2 gram dan 1,2 gram
Jawaban : C
Pembahasan :
Fe : S = 7 : 4
Jumlah perbandingan = 7 + 4 = 11
Massa belerang yang diperlukan = 4/11 x 4,4 = 1,6 gram.
3. Suatu reaksi: tembaga + belerang→tembaga(II)sulfida. Jika 63.5 gram tembaga direaksikan dengan 32 gram belerang akan menghasilkan 95,5 gram tembaga(II)sulfida.Jika yangdireaksikan 16 gram tembaga dengan 8 gram belerang maka massa tembaga(II)sulfida yang dihasilkan adalah …. gram
a. 23,875
b. 24,000
c. 15,875
d. 10,000
e. 8,050
Jawaban: B
Pembahasan:
Tembag +belerang→ tembaga(II)sulfide
16 Gram 8 gram 24,000 gram.
4. Perubahan massa atom disebabkan perubahan standar. Hitung massa atom hidrogen dan karbon menurut standar Berzelius (O = 100). Jawablah dengan menggunakan satu tempat desimal.
Jawab.
Massa atom hidrogen = 1 x (100/16) = 6,25 (6,3), massa atom karbon = 12 x (100/16)=75,0
Massa atom hampir semua unsur sangat dekat dengan bilangan bulat, yakni kelipatan bulat massa atom hidrogen. Hal ini merupakan kosekuensi alami fakta bahwa massa atom hidrogen sama dengan massa proton, yang selanjutnya hampir sama dengan massa neutron, dan massa elektron sangat kecil hingga dapat diabaikan.
Namun, sebagian besar unsur yang ada secara alami adalah campuran beberapa isotop, dan massa atom bergantung pada distribusi isotop. Misalnya, massa atom hidrogen dan oksigen adalah 1,00704 dan 15,9994. Massa atom oksigen sangat dekat dengan nilai 16 agak sedikit lebih kecil.
5. Sewaktu sampel hidrat dari tembaga (II) sulfat dipanaskan, massanya berkurang sebanyak 36 %. Rumus molekul hidrat tersebut adalah…
(Ar Cu = 63,5; S = 32; O = 16; H = 1)
a. CuSO4 . 5H2O
b. CuSO4 . 4H2O
c. CuSO4 . 3H2O
d. CuSO4 . 2H2O
e. CuSO4 . H2O
Jawaban : A
Pembahasan :
Misalkan massa kristal = 100 gram
Massa kristal berkurang 36 %, sehingga massa kristal yang tersisa adalah :
Massa CuSO4 = (100 – 36) gram
= 64 gram
Massa H2O = 36 gram
Perbandingan mol CuSO4 . H2O = (64/159,5) / (36/18) = 0,40 : 2
= 1 : 5
6. Hitung massa atom magnesium dengan menggunakan distribsui isotop berikut: 24Mg: 78,70%; 25Mg: 10,13%, 26Mg: 11,17%.
Jawab:
0,7870 x 24 + 0,1013 x 25 +0,1117 x 26 = 18,89+2,533+2,904 = 24,327(amu; lihat bab 1.3(e))
Massa atom Mg = 18,89 + 2,533 + 2,904 =24.327 (amu).
Perbedaan kecil dari massa atom yang ditemukan di tabel periodik (24.305) hasil dari perbedaan cara dalam membulatkan angkanya.
hitunglah massa dari gas metana 1,23 liter diukur pada suhu 25c dan tekanan 1 atm.
7. Reaksi:Na: + C2H5OH → C2H5ONa + H2Koefisien reaksi berturut-turut adalah…
a. 1 1 1 1
b. 1 1 1 2
c. 1 1 2 2
d. 1 2 2 2
e. 2 2 2 1
Jawaban : E
Dalam menyetarakan persamaan reaksi sederhana perlu diperhatikan hal-hal berikut diantaranya jumlah atom-atom sebelum reaksi (di belakang tandapanah) harus sama dengan jumlah atom-atom sesudah reaksi (di depan tanda panah). Untuk mengetahui koefisien reaksi di atas, maka dilakukan pengujian terhadap persamaan reaksi. Sehingga diperoleh persamaan reaksi sebagai berikut:
2Na + 2C2H5OH → 2C2H5ONa + 1H2
Dimana jumlah atom di belakang tanda panah sama dengan jumlah atom di depan tanda panah, yaitu:
- Atom Na di belakang tanda panah berjumlah 2 sama dengan atom Na di depan tanda panah
- Atom C di belakang tanda panah berjumlah 4 sama dengan atom C di depan tanda panah
- Atom H di belakang tanda panah berjumlah 12 sama dengan atom H di depan tanda panah
- Atom O di belakang tanda panah berjumlah 2 sama dengan atom O di depan tanda panah
8. Dalam 15,9 gram senyawa tembaga (I)sulfide (Ar: Cu = 63,5 dan S= 32) terdapat Cu sebanyak…
a. 63,5 g
b. 25,40 g
c. 15,00 g
d. 15,90 g
e. 12,70 g
Jawaban: A
Pembahasan:
Diketahui: 15,9 g senyawa Cu2S, Ar Cu=63,5 dan S=32
Ditanya: massa Cu?
Mr Cu2S =( 2 x 63,5) + 32 = 159
Cu= Ar Cu / Mr Cu 2S x massa Cu2S
Cu= 63,5/159 x 15,9
C=6,35gram.
9. Gas hidrogen dapat dibuat dari reaksi alumunium dengan larutan natrium hidroksida sesuai dengan persamaan:
2Al(s)+ 2NaOH(aq)+ 6H2O(l) → 2NaAl(OH)4(aq) + 3H2(g)
Massa Alumunium (Ar = 27) yang diperlukan untuk membuat 44,8 liter gas hidrogen (STP) adalah…
a. 18 gram
b. 36 gram
c. 54 gram
d. 72 gram
e. 81 gram
Jawaban : C
Pembahasan :
Langkah 1: Tulis persamaan reaksi dan setarakan
2Al(s) + 2NaOH(aq) + 6H2O(l) → 2NaAl(OH)4(aq) + 3H2(g)
setara
Langkah 2:
Ubah satuan jumlah zat yang ada menjadi satuan mol maka
n = V/22,4
= 44,8/22,4 liter/mol
Langkah 3:
Cari satuan yang ditanyakan pada soal, pada soal dijelaskan massa Al yang diperlukan :
Massa = n Ar
Massa = 2 mol 27 gram/mol
Massa = 54 gram.
10. Molekul NH3 sebanyak 0,5 mol pada suhu dan tekanan 1 atm akan menempati ruang yang volumenya….
a. 44,8 liter
b. 22,4 liter
c. 11,2 liter
d. 9,6 liter
e. 5,6 liter
Jawaban : C
Pembahasan :
Diketahui:
n = 0,5 mol
T = 0 °C = 273 K
P = 1 atm
R = 0,082 L atm mol-1 K-1
Ditanya : Volume ?
Jawaban:
Hukum gas ideal
PV = n R T
V = n R T / P
= (0,5 mol x 0,0082 L atm mol-1K-1 x 273K) / (1 atm)
V = 11,193 L = 11,2L
Bacaan Lainnya
- Volume Molar – Massa Molar (mol) – Rumus, Contoh Soal dan Jawaban
- Jari-Jari Atom – Jenis dan Nilai jari-jari atom
- Atom – Pengertian, Teori, Sifat, Struktur, Susunan
- Konfigurasi Elektron – Penjelasan Tabel konfigurasi elektron
- Reduktor dan Oksidator – Penjelasan, Contoh Soal dan Jawaban
- Bilangan Oksidasi Kimia (Biloks) – Aturan Penentuan Biloks, Tabel, Contoh Soal dan Jawaban
- Pembakaran Kimia – Persamaan Kimia – Sempurna & Tak Sempurna dan Contoh Soal beserta Jawabannya
- Tabel Periodik Lengkap Dengan Daftar Unsur Kimia Berdasarkan Nama, Warna dan Jenis
- Rumus Kimia Konsep Mol dan Empiris Beserta Contoh Soal & Jawaban
- Unsur, Senyawa dan Campuran Kimia – Beserta Penjelasan & Rumus
- Rumus Fisika: Alat optik: Lup, Mikroskop, Teropong Bintang, Energi, Frekuensi, Gaya, Gerak, Getaran, Kalor, Massa jenis, Medan magnet, Mekanika fluida, Momen Inersia, Panjang gelombang, Pemuaian, Percepatan (akselerasi), Radioaktif, Rangkaian listrik, Relativitas, Tekanan, Usaha Termodinamika, Vektor
- Bagaimana Albert Einstein mendapatkan rumus E=mc² ?
- Cara Mengemudi Aman Pada Saat Mudik atau Liburan Panjang
- Jenis Virus Komputer – Cara Gratis Mengatasi Dengan Windows Defender
Sumber bacaan: Libretexts, Sparknotes, Lumen Learning
Pinter Pandai “Bersama-Sama Berbagi Ilmu”
Quiz |Matematika|IPA | Geografi & Sejarah|Info Unik|Lainnya