Elektrokimia
Elektrokimia adalah reaksi redoks yang bersangkut paut dengan listrik.
Reaksi elektrokimia dibagi menjadi 2, yaitu:
- Sel galvani/sel volta adalah reaksi redoks yang menghasilkan listrik. Contohnya baterai.
- Sel elektrolisis adalah listrik yang mengakibatkan reaksi redoks. Contohnya adalah pemurnian logam dan pelapisan logam.
Reaksi elektrokimia dapat berlangsung secara spontan,yaitu ketika dua elektrode yang direndam di dalam cairan elektrolit dihubungkan dengan untai listrik.
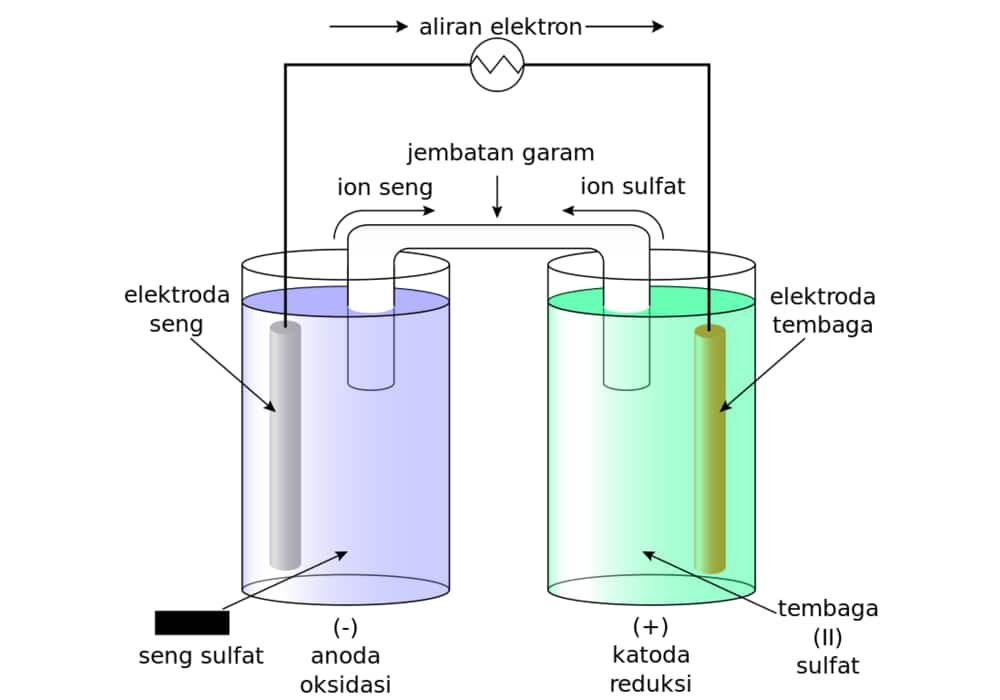
Sel galvani/sel volta
Pada gambar dibawah ini, logam Zn akan mengalami oksidasi, sedangkan logam Cu akan mengalami reduksi.
Reaksi kimia sel galvani / selvolta
- Zn → Zn2+ + 2 e, E0 = 0,76 volt
- Cu2+ + 2 e → Cu, E0 = 0,34 volt
- Zn + Cu2+ → Zn2+ + Cu, Esel = 1,1 Volt.
Fungsi dari jembatan garam adalah untuk menetralkan kelebihan anion dan kation pada larutan dan untuk menutup rangkaian sehingga reaksi dapat berlangsung terus-menerus.

Notasi sel
Untuk sel volta, penulisannya adalah: anoda || katoda atau zat yang teroksidasi || zat yang tereduksi
Seperti pada contoh diatas, berarti notasi selnya adalah:
- Zn | Zn2+ || Cu2+ | Cu, Esel= 1,1 volt
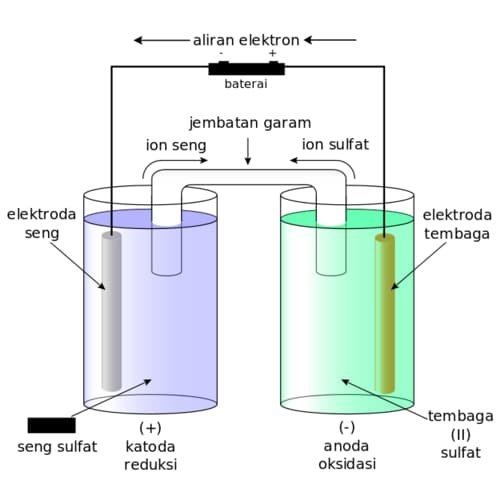
Sel elektrolisis
Sel elektrolisis adalah arus listrik yang menimbulkan reaksi redoks.
Pada sel elektrolisis, katoda akan tereduksi dan anoda yang akan teroksidasi.
Pada katoda, terdapat 2 kemungkinan zat yang ada
- kation (K+) atau
- air (H20) (bisa ada atau tidak ada tergantung dari apa yang disebutkan, cairan atau lelehan.)
Pada anoda, terdapat 3 kemungkinan zat yang ada
- anion (A–) atau
- air (H20) (bisa ada atau tidak ada tergantung dari apa yang disebutkan, cairan atau lelehan.)
- elektroda, elektroda ada 2 macam, inert (tidak mudah bereaksi, ada 3 macam zat yaitu platina (Pt), emas (Aurum/Au), dan karbon (C)) dan tak inert (mudah bereaksi, zat lainnya selain Pt, C, dan Au).
Ada berbagai macam reaksi pada sel elektrolisis
- Reaksi yang terjadi pada katoda
- Jika kation merupakan logam golongan IA (Li, Na, K, Rb, Cs, Fr), IIA (Be, Mg, Cr, Sr, Ba, Ra), Al, dan Mn, maka reaksi yang terjadi adalah 2 H20 + 2 e → H2 + 2 OH–
- Jika kationnya berupa H+, maka reaksinya 2H+ + 2 e → H2
- Jika kation berupa logam lain, maka reaksinya (nama logam)x+ + xe → (nama logam)
- Reaksi yang terjadi pada anoda
- Jika elektroda inert (Pt, C, dan Au), ada 3 macam reaksi:
- Jika anionnya sisa asam oksi (misalnya NO3–, SO42-), maka reaksinya 2 H20 → 4H+ + O2 + 4 e
- Jika anionnya OH–, maka reaksinya 4 OH– → 2H20 + O2 + 4 e
- Jika anionnya berupa halida (F–, Cl–, Br–), maka reaksinya adalah 2 X(halida) → X (halida)2 + 2 e
- Jika elektroda inert (Pt, C, dan Au), ada 3 macam reaksi:
- Jika elektroda tak inert (selain 3 macam di atas), maka reaksinya L” > Lx+ + xe
Contoh Soal dan Jawaban Elektrokimia
Suatu sel volta diaplikasikan untuk berbagai jenis baterai. Berikut ini yang termasuk sel sekunder adalah…
A) Sel Leclanche
B) Sel zink-perak
C) Aki basah
D) A dan B benar
E) B dan C benar
Jawaban:
Yang benar adalah C. Aki basah termasuk sel volta sekunder (dapat diisi ulang).
Reaksi yang terjadi pada katode dari elektrolisis larutan Na2SO4 adalah…
A. 2H2O (aq) + 2e 2OH- (aq) + H2 (g)
B. 2H+ (aq) + 2e H2 (g)
C. Na+ (aq) + e Na (s)
D. SO42- (aq) + 2e SO4 (aq)
E. 4OH- (aq) 2H2O (aq) + O2 (g) + 4e
Jawaban: A
Penyelesaian:
Na2SO4 2Na+ + SO42-
Pada katoda : 2H2O + 2e 2OH- + H2
anoda : 2H2O 4H+ + O2 + 4e
Baterai lithium-ion (Li-ion) adalah primadona pada era ini, penggunaannya sangat luas mulai dari telepon genggam hingga komputer jinjing. Manakah di antara pernyataan berikut mengenai baterai ini yang paling tepat?
A) Baterai Li-ion termasuk sel primer
B) Baterai Li-ion tidak menggunakan elektrolit
C) Baterai Li-ion menggunakan grafit sebagai katode
D) Baterai Li-ion menggunakan lithium kobalt (IV) oksida sebagai katode
E) Tidak ada pilihan yang tepat
Jawaban:
Jawaban yang benar adalah E) Tidak ada pilihan yang tepat. Baterai Li-ion termasuk sel sekunder, menggunakan LiPF6 sebagai elektrolit serta grafit sebagai anode dan lithium kobalt (III) oksida sebagai katode.
Pada elektrolisis Al2O3 (pengolahan Aluminium) sebanyak 102 kg dihasilkan Al …. (Al = 27, O =16)
Jawaban:
Al2O3
102 kg = 102000 gram1 mol Al2O3 dihasilkan 2 mol Al3+1000 mol
Al2O3 dihasilkan 2000 mol Al3+3e + Al3+ Al1 mol Al3+ ~ 1 mol Al2000 mol
Al3+ ~ 2000 mol Al
Jadi yang terjadi = 2000 mol= 2000 x 27 gram= 54.000 gram = 54 kg
Waktu yang diperlukan untuk melapisi suatu permukaan besi dengan 3,05 gram air seng dalam larutan ion seng yang dialirkan arus listrik sebesar 5 ampere adalah …. (F = 96500, Ar Zn = 65,4)
A. 4 menit 2 detik
B. 15 menit 15 detik
C. 60 menit 0 detik
D. 375 menit 2 detik
E. 30 menit 0 detik
Jawaban : E
Penyelesaian :
I = 5 ; V = Valensi seng = 2
Berat = 3,05
Bacaan Lainnya
- Tabel Periodik Lengkap Dengan Daftar Unsur Kimia Berdasarkan Nama, Warna dan Jenis
- Unsur, Senyawa dan Campuran Kimia – Beserta Penjelasan & Rumus
- Rumus Fisika: Alat optik: Lup, Mikroskop, Teropong Bintang, Energi, Frekuensi, Gaya, Gerak, Getaran, Kalor, Massa jenis, Medan magnet, Mekanika fluida, Momen Inersia, Panjang gelombang, Pemuaian, Percepatan (akselerasi), Radioaktif, Rangkaian listrik, Relativitas, Tekanan, Usaha Termodinamika, Vektor
- Bagaimana Albert Einstein mendapatkan rumus E=mc² ?
- Cara Mengemudi Aman Pada Saat Mudik atau Liburan Panjang
- Jenis Virus Komputer – Cara Gratis Mengatasi Dengan Windows Defender
- Cara Menghentikan Penindasan Bullying
- Cara menjaga keluarga Anda aman dari teroris – Ahli anti-teror menerbitkan panduan praktis
- Apakah Anda Memerlukan Asuransi Jiwa? – Cara Memilih Asuransi Jiwa Untuk Pembeli Yang Pintar
- 10 Cara Memotivasi Anak Untuk Belajar Agar Menjadi Pintar
- Di Indonesia, (HAN) Hari Anak Nasional tanggal 23 Juli
- Ibu Hamil Dan Bahaya Kafein – Sayur & Buah Yang Baik Pada Masa Kehamilan
- Daftar Jenis Kanker: Pemahaman Kanker, Mengenal Dasar-Dasar, Contoh Kanker, Bentuk, Klasifikasi, Sel dan Pemahaman Penyakit Kanker Lebih Jelas
- Penyebab Dan Cara Mengatasi Iritasi Atau Lecet Akibat Pembalut Wanita
- Sistem Reproduksi Manusia, Hewan dan Tumbuhan
- Cara Mengenal Karakter Orang Dari 5 Pertanyaan Berikut Ini
- Kepalan Tangan Menandakan Karakter Anda & Kepalan nomer berapa yang Anda miliki?
Unduh / Download Aplikasi HP Pinter Pandai
Respons “Ooo begitu ya…” akan lebih sering terdengar jika Anda mengunduh aplikasi kita!
Siapa bilang mau pintar harus bayar? Aplikasi Ilmu pengetahuan dan informasi yang membuat Anda menjadi lebih smart!
Pinter Pandai “Bersama-Sama Berbagi Ilmu”
Quiz | Matematika | IPA | Geografi & Sejarah | Info Unik | Lainnya