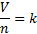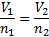Gas Ideal
Gas ideal adalah gas teoretis yang terdiri dari partikel-partikel titik yang bergerak secara acak dan tidak saling berinteraksi. Konsep gas ideal sangat berguna karena memenuhi hukum gas ideal, sebuah persamaan keadaan yang disederhanakan, sehingga dapat dianalisis dengan mekanika statistika.
Pada kondisi normal seperti temperatur dan tekanan standar, kebanyakan gas nyata berperilaku seperti gas ideal. Banyak gas seperti nitrogen, oksigen, hidrogen, gas mulia dan karbon dioksida dapat diperlakukan seperti gas ideal dengan perbedaan yang masih dapat ditolerir.
Perilaku gas
Secara umum, gas berperilaku seperti gas ideal pada temperatur tinggi dan tekanan rendah, karena kerja yang melawan gaya intermolekuler menjadi jauh lebih kecil bila dibandingkan dengan energi kinetik partikel, dan ukuran molekul juga menjadi jauh lebih kecil bila dibandingkan dengan ruangan kosong antar molekul.
Model gas ideal tak dapat dipakai pada suhu rendah atau tekanan tinggi, karena gaya intermolekuler dan ukuran molekuler menjadi penting. Model gas ideal juga tak dapat dipakai pada gas-gas berat seperti refrigeran atau gas dengan gaya intermolekuler kuat, seperti uap air. Pada beberapa titik ketika suhu rendah dan tekanan tinggi, gas nyata akan menjalani fase transisi menjadi liquid atau solid. Model gas ideal tidak dapat menjelaskan atau memperbolehkan fase transisi. Hal ini dapat dijelaskan dengan persamaan keadaan yang lebih kompleks.
Rumus gas ideal
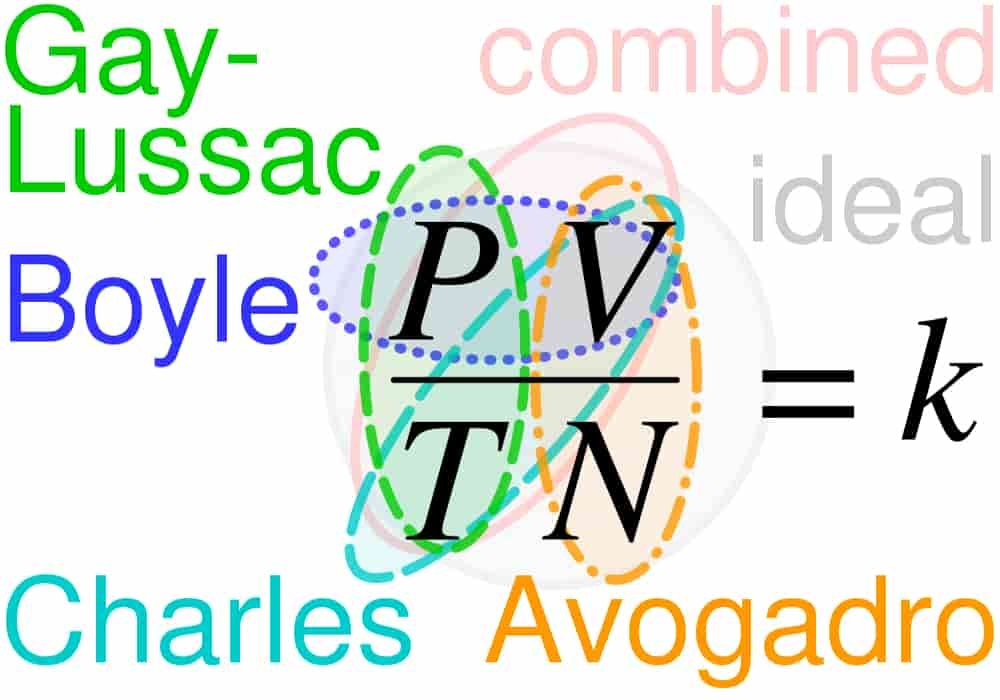
Persamaan gas ideal adalah persamaan keadaan suatu gas ideal.
Persamaan ini merupakan pendekatan yang baik untuk karakteristik beberapa gas pada kondisi tertentu. Persamaan ini pertama kali dicetuskan oleh Émile Clapeyron tahun 1834 sebagai kombinasi dari Hukum Boyle dan Hukum Charles. Persamaan ini umum dituliskan sebagai
Yang dimana:
- P adalah tekanan mutlak pada gas.
- V adalah volume.
- n adalah jumlah partikel pada gas (dalam mol)
- T adalah temperatur dalam satuan kelvin, dan R adalah konstanta gas ideal, yaitu 0,08205 L atm mol-1 K-1.
Persamaan ini juga dapat diturunkan dari teori kinetik, yang dicetuskan secara terpisah oleh August Krönig tahun 1856 dan Rudolf Clausius tahun 1857.
Konstanta gas universal ditemukan dan pertama kali diperkenalkan ke hukum gas ideal oleh Dmitri Mendeleev tahun 1874.
Persamaan gas ideal bermanfaat terutama dalam stoikiometri gas.
Dalam ilmu kimia, stoikiometri (kadang disebut stoikiometri reaksi untuk membedakannya dari stoikiometri komposisi) adalah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia). Kata ini berasal dari bahasa Yunani stoikheion (elemen) dan metriā (ukuran).
Stoikiometri didasarkan pada hukum-hukum dasar kimia, yaitu hukum kekekalan massa, hukum perbandingan tetap, dan hukum perbandingan berganda.
Contoh:
{\displaystyle {\rm {{}\left({\frac {85\ g\ Fe_{2}O_{3}}{1}}\right)\left({\frac {1\ mol\ Fe_{2}O_{3}}{160\ g\ Fe_{2}O_{3}}}\right)\left({\frac {2\ mol\ Al}{1\ mol\ Fe_{2}O_{3}}}\right)\left({\frac {27\ g\ Al}{1\ mol\ Al}}\right)=28.6875\ g\ Al}}}
Stoikiometri gas adalah suatu bentuk khusus, di mana reaktan dan produknya seluruhnya berupa gas. Dalam kasus ini, koefisien zat (yang menyatakan perbandingan mol dalam stoikiometri reaksi) juga sekaligus menyatakan perbandingan volume antara zat-zat yang terlibat.
Rumus Hukum Avogadro
Untuk suatu massa dari gas ideal, volume dan mol gas secara langsung akan proporsional jika suhu dan tekanannya konstan. Persamaan tersebut dapat ditulis sebagai berikut:
Dimana:
- V adalah volume gas
- n adalah jumlah zat dari gas (dalam satuan mol)
- k adalah konstanta yang sama dengan RT/P, di mana R adalah konstanta gas universal, T adalah suhu Kelvin, dan P adalah tekanan. Sebagai suhu dan tekanan yang konstan, RT/P juga konstan dan disebut sebagai k. Ini berasal dari hukum gas ideal.
Hukum ini menjelaskan bagaimana dalam kondisi suhu, tekanan, dan volume gas yang sama pasti mengandung jumlah molekul yang sama. Untuk membandingkan substansi yang sama di bawah dua set yang kondisinya berbeda, hukum ini dapat dinyatakan sebagai berikut:
Persamaan ini menunjukkan bahwa, jika jumlah mol gas meningkat, volume gas juga akan meningkat secara proporsional. Dan sebaliknya, jika jumlah mol gas berkurang, maka volume juga menurun.
Konstanta gas
Konstanta gas (disebut juga konstanta gas ideal, molar, semesta, atau universal, biasanya dilambangkan dengan huruf R) adalah sebuah konstanta fisika yang sering muncul dalam banyak persamaan fundamental fisika, seperti hukum gas ideal dan persamaan Nernst. Konstanta ini ekuivalen dengan konstanta Boltzmann, tetapi dinyatakan dalam satuan energi per kelvin per mol (daripada energi per kelvin per partikel).
Harganya adalah:
- R = 8.314472(15) J · K-1 · mol-1
Dua digit di dalam kurung adalah ketidakpastian (deviasi standar) pada harga dua digit terakhir.
Konstanta gas didapatkan dari persamaan keadaan paling sederhana, hukum gas ideal, sebagai berikut:
dengan:
- adalah tekanan absolut
- adalah temperatur absolut
- adalah volume “ruang” yang ditempati
- adalah jumlah gas (jumlah molekul gas, biasanya dalam mol)
- adalah volume molar
Hubungan dengan konstanta Boltzmann
Konstanta Boltzmann kB (sering disingkat k) dapat digunakan menggantikan konstanta gas asalkan bekerja dalam kondisi hitung partikel murni, N, dan bukan jumlah substansi, n, sehingga:
dengan NA adalan bilangan Avogadro. Sebagai contoh, hukum gas ideal dengan konstanta Boltzmann adalah
dengan N adalah jumlah partikel (dalam hal ini adalah molekul), atau untuk mengeralisir pada sistem yang tidak homogen, persamaan menjadi:
dengan n adalah bilangan kerapatan.
Konstanta Boltzmann kB (kadang disingkat k) dapat digunakan sebagai konstanta gas ideal dengan menghitung jumlah partikel, N, daripada jumlah substansi, n, dengan:
dengan NA adalah konstanta Avogadro. Sebagai contoh, hukum gas ideal dengan menggunakan konstanta Boltzmann adalah
dengan N adalah jumlah partikel/molekul.
Konstanta gas spesifik
| Rspesifik untuk udara kering | Satuan |
|---|---|
| 287.058 | J kg−1 K−1 |
| 53.3533 | ft lbf lb−1 °R−1 |
| 1716.49 | ft lbf slug−1 °R−1 |
| Berdasarkan rerata massa molar untuk udara kering 28.9645 g/mol. | |
Konstanta gas spesifik suatu gas atau campuran gas (Rspesifik) sama dengan konstanta gas molar (R) dibagi dengan massa molar (M) gas atau campuran gas
Seperti konstanta gas ideal yang berhubungan dengan tetapan Boltzmann, tetapan gas spesifik juga merupakan hasil dari pembagian konstanta Boltzmann dengan massa molekul gas.
Hubungan penting lainnya diperoleh dari termodinamika. Relasi Mayer menghubungkan konstanta gas spesifik dengan panas spesifik pada gas sempurna berkalori.
dengan cp adalan panas spesifik pada tekanan tetap dan cv panas spesifik pada volume tetap.
Sudah menjadi hal umum, terutama di bidang teknik, menuliskan konstanta gas spesifik dengan simbol R. Dalam kasus seperti ini, konstanta gas universal biasanya diberikan pembeda seperti R. Apapun itu, konteks dan/atau satuan konstanta gas yang digunakan harus jelas apakah yang dimaksud adalah konstanta gas universal atau spesifik.
Tetapan gas Dimensi R
Dari persamaan umum PV = nRT diperoleh:
di mana P adalah tekanan, V adalah volume, n adalah jumlah mol, dan T adalah suhu.
Karena tekanan didefinisikan sebagai gaya per satuan luas, persamaan gas dapat juga ditulis sebagai:
Luas dan volume kira-kira adalah (panjang)2 dan (panjang)3. Oleh karena itu:
Karena gaya × panjang = kerja:
Kebermaknaan fisika R bekerja pada level per derajat per mol. Hal itu dapat dinyatakan dalam semua set satuan yang mewakili kerja dan energi (misalnya joule). Satuan lain yang mewakili suhu (seperti Celsius atau Fahrenheit), dan sistem apapun dengan satuan yang merujuk pada mol atau jumlah kemurnian yang sama yang memungkinkan persamaan massa makroskopik dan jumlah partikel dasar dalam sistem, seperti dalam gas ideal.
Pengukuran tetapan gas
ca(p, T) dalam argon pada suhu T dari titik tripel air (digunakan untuk mendefinisikan kelvin) pada tekanan p yang berbeda, dan mengekstrapolasinya pada batas tekanan-nol ca(0, T).
dengan:
- γ0 adalah rasio kapasitas panas (5/3 untuk gas monoatomik seperti argon);
- T adalah suhu, TTPW = 273.16 K menurut definisi kelvin;
- Ar(Ar) adalah massa atom relatif argon; dan
- Mu = 10−3 kg mol−1.

Gas Ideal Termodinamika Klasik
Karakteristik termodinamika gas ideal dapat dijelaskan dengan 2 persamaan: Persamaan keadaan gas ideal adalah hukum gas ideal
Persamaan ini diturunkan dari Hukum Boyle: (pada n dan T konstan); Hukum Charles: (pada P dan n konstan); dan Hukum Avogadro: (pada P dan T konstan). Dengan menggabungkan ketiga hukum tersebut, maka menjadi yang artinya.
Pada kondisi ideal, {\displaystyle V=R\left({\frac {Tn}{P}}\right)} ; maka, {\displaystyle PV=nRT}.
Energi dalam gas ideal dinyatakan dengan:
dengan
- tekanan
- volume
- jumlah substansi gas dalam mol
- konstanta gas
- temperatur mutlak
- konstanta Hukum Boyle
- konstanta proporsional, sama dengan
- konstanta proporsional, sama dengan
- energi dalam
- kapasitas panas spesifik pada volume konstan, ≈ 3/2 untuk gas monoatom, 5/2 untuk gas diatom dan 3 untuk molekul lain yang lebih kompleks. Untuk mengubah dari besaran makroskopik ke mikroskopik, maka digunakan
dengan
- adalah jumlah partikel gas
- adalah konstanta Boltzmann (1.381×10−23J·K−1).
Kemungkinan distribusi partikel dari kecepatan atau energi dapat menggunakan distribusi kecepatan Maxwell.
Hukum ideal gas adalah lanjutan dari hukum gas yang ditemukan secara percobaan. Fluida nyata pada densitas rendah dan temperatur tinggi hampir mengikuti hukum gas ideal. Namun, pada temperatur rendah atau densitas tinggi, fluida nyata mengalami penyimpangan jauh dari sifat gas ideal, terutama karena terkondensasi menjadi liquid atau terdeposisi menjadi padat. Penyimpangan ini dinyatakan dalam faktor kompresibilitas.
Model gas ideal mengikuti asumsi berikut ini:
- Molekul gas tidak dibedakan, berukuran kecil, dan berbentuk bola
- Semua tabrakan antar gas bersifat elastis dan semua gerakannya tanpa friksi (tidak ada energi hilang pada gerakan atau tabrakan)
- Menggunakan hukum Newton
- Jarak rata-rata antar molekul jauh lebih besar daripada ukuran molekul
- Molekul secara konstan bergerak pada arah acak dengan distribusi kecepatan
- Tidak ada gaya atraktif atau repulsif antara molekul atau sekitarnya
Konstanta Gas Ideal
Konstanta gas (disebut juga konstanta gas ideal, molar, semesta, atau universal, biasanya dilambangkan dengan huruf R) merupakan sebuah konstanta fisika yang merupakan konstanta dasar dalam berbagai persamaan ilmu fisika, seperti hukum gas ideal dan persamaan Nernst.
Konstanta ini ekivalen dengan konstanta Boltzmann, tetapi dinyatakan dalam satuan energi (yaitu: hasil kali tekanan-volume) per kenaikan suhu per mol (bukan energi per kenaikan suhu per partikel). Tetapan ini juga merupakan kombinasi dari konstanta hukum Boyle, Charles, Avogadro, dan Gay-Lussac.
Secara fisik, kanstanta gas adalah konstanta kesebandingan terhadap kejadian yang menghubungkan skala energi dengan skala suhu, dengan mol partikel pada suhu dasar sebagai acuan.
Oleh karena itu, nilai tetapan gas terutama diturunkan dari keputusan dan kejadian historis dalam pengaturan skala energi dan suhu, ditambah pengaturan historikal sejenis nilai skala molar yang digunakan untuk menghitung partikel. Faktor terakhir yang tidak diperhitungkan adalah nilai konstanta Boltzmann, yang memiliki peran yang sama dalam menghitung linearitas skala energi dan suhu.
Nilai tetapan gas adalah:
8.3144598(48) J mol−1 K−1
Dua digit terakhir dalam kurung adalah nilai ketakpastian (standar deviasi). Ketakpastian relatif adalah 9.1 × 10−7.
Beberapa orang menyarankan memberi nama tetapan ini dengan simbol R, tetapan Regnault, sebagai penghormatan kepada kimiawan Prancis Henri Victor Regnault, yang data penelitiannya digunakan untuk menghitung nilai awal tetapan ini. Meski demikian, alasan pasti asal muasal penggunaan huruf R untuk tetapan ini masih sukar dipahami.
Konstanta gas muncul dalam hukum gas ideal sebagai berikut:
dengan, P adalah tekanan absolut (SI: pascal), V adalah volume gas (SI: meter kubik), N adalah jumlah gas (SI: mol), m adalah massa (SI: kilogram) yang terkandung dalam V, dan T adalah suhu termodinamika (SI: Kelvin). Konstanta gas dinyatakan dalam satuan fisika yang sama dengan entropi molar dan kapasitas panas molar.
Dimensi R
Dari persamaan umum PV = nRT diperoleh:
di mana P adalah tekanan, V adalah volume, n adalah jumlah mol, dan T adalah suhu.
Karena tekanan didefinisikan sebagai gaya per satuan luas, persamaan gas dapat juga ditulis sebagai:
Luas dan volume kira-kira adalah (panjang)2 dan (panjang)3. Oleh karena itu:
Karena gaya × panjang = kerja:
Kebermaknaan fisika R bekerja pada level per derajat per mol. Hal itu dapat dinyatakan dalam semua set satuan yang mewakili kerja dan energi (misalnya joule). Satuan lain yang mewakili suhu (seperti Celsius atau Fahrenheit), dan sistem apapun dengan satuan yang merujuk pada mol atau jumlah kemurnian yang sama yang memungkinkan persamaan massa makroskopik dan jumlah partikel dasar dalam sistem, seperti dalam gas ideal (lihat Bilangan Avogadro)
Hubungan dengan konstanta Boltzmann
Konstanta Boltzmann kB (sering disingkat k) dapat digunakan menggantikan konstanta gas asalkan bekerja dalam kondisi hitung partikel murni, N, dan bukan jumlah substansi, n, sehingga:
dengan NA adalan bilangan Avogadro. Sebagai contoh, hukum gas ideal dengan konstanta Boltzmann adalah
dengan N adalah jumlah partikel (dalam hal ini adalah molekul), atau untuk mengeralisir pada sistem yang tidak homogen, persamaan menjadi:
dengan n adalah bilangan kerapatan.
Pengukuran Konstanta Gas Ideal
ca(p, T) dalam argon pada suhu T dari titik tripel air (digunakan untuk mendefinisikan kelvin) pada tekanan p yang berbeda, dan mengekstrapolasinya pada batas tekanan-nol ca(0, T).
dengan:
- γ0 adalah rasio kapasitas panas (5/3 untuk gas monoatomik seperti argon);
- T adalah suhu, TTPW = 273.16 K menurut definisi kelvin;
- Ar(Ar) adalah massa atom relatif argon; dan
- Mu = 10−3 kg mol−1.
Konstanta gas spesifik
| Rspesifik untuk udara kering | Satuan |
|---|---|
| 287.058 | J kg−1 K−1 |
| 53.3533 | ft lbf lb−1 °R−1 |
| 1716.49 | ft lbf slug−1 °R−1 |
| Berdasarkan rerata massa molar untuk udara kering 28.9645 g/mol. | |
Konstanta gas spesifik suatu gas atau campuran gas (Rspesifik) sama dengan konstanta gas molar (R) dibagi dengan massa molar (M) gas atau campuran gas
Seperti konstanta gas ideal yang berhubungan dengan tetapan Boltzmann, tetapan gas spesifik juga merupakan hasil dari pembagian konstanta Boltzmann dengan massa molekul gas.
Hubungan penting lainnya diperoleh dari termodinamika. Relasi Mayer menghubungkan konstanta gas spesifik dengan panas spesifik pada gas sempurna berkalori.
dengan cp adalan panas spesifik pada tekanan tetap dan cv panas spesifik pada volume tetap.
Sudah menjadi hal umum, terutama di bidang teknik, menuliskan konstanta gas spesifik dengan simbol R. Dalam kasus seperti ini, konstanta gas universal biasanya diberikan pembeda seperti R. Apapun itu, konteks dan/atau satuan konstanta gas yang digunakan harus jelas apakah yang dimaksud adalah konstanta gas universal atau spesifik.
Soal dan Jawaban Gas Ideal
1) Sebanyak 35 L gas karbon dioksida mengandung 4,5 x 1023 molekul pada suhu dan tekanan yang sama, tentukan :
a. Jumlah molekul 7 L gas hidroge
b. Volume gas amoniak yang mengandung 9 x 1023 molekul
2) Hitung massa H2S yang terdapat dalam ruang 30 liter dengan temperatur 27°C dan dengan tekanan 1,1 atm.
n = (1,1 atm x 30 liter) / (80,082 liter atm mol -1K-1 x 300 K)
3) Hitung volume 14 gram gas nitrogen yang memiliki temperatur 25°C dengan tekanan 0,75 atm.
V = [ (0,5 mol) x (0,082 liter mol -1K-1 K) x (298) ] / (0,75 atm
Bacaan Lainnya
- Rumus Fisika: Alat optik: Lup, Mikroskop, Teropong Bintang, Energi, Frekuensi, Gaya, Gerak, Getaran, Kalor, Massa jenis, Medan magnet, Mekanika fluida, Momen Inersia, Panjang gelombang, Pemuaian, Percepatan (akselerasi), Radioaktif, Rangkaian listrik, Relativitas, Tekanan, Usaha Termodinamika, Vektor
- Rumus Kimia Konsep Mol Dan Empiris Beserta Contoh Soal Dan Jawaban
- Sebagian cabang biologi: Biofisika
- Contoh Soal SBMPTN Beserta Jawabannya
- Tabel Periodik Lengkap Dengan Daftar Unsur Kimia Berdasarkan Nama, Warna Dan Jenis
- Pemahaman Kanker: Mengenal Dasar-Dasar, Contoh Kanker, Bentuk, Klasifikasi, Sel dan Pemahaman Penyakit Kanker Lebih Jelas
- Apakah Produk Pembalut Wanita Aman?
- Penyakit Difteri Penularan, Penyebab, Gejala, Perawatan dan Pencegahan
- Penyakit Kusta Penularan, Penyebab, Gejala, Perawatan dan Pencegahan
- Sakit Punggung: Penyebab, gejala, pencegahan dan perawatan
- Penyebab Dan Cara Mengatasi Iritasi Atau Lecet Akibat Pembalut Wanita
- Sistem Reproduksi Manusia, Hewan dan Tumbuhan
- Cara Mengenal Karakter Orang Dari 5 Pertanyaan Berikut Ini
- Kepalan Tangan Menandakan Karakter Anda & Kepalan nomer berapa yang Anda miliki?
Unduh / Download Aplikasi HP Pinter Pandai
Respons “Ooo begitu ya…” akan lebih sering terdengar jika Anda mengunduh aplikasi kita!
Siapa bilang mau pintar harus bayar? Aplikasi Ilmu pengetahuan dan informasi yang membuat Anda menjadi lebih smart!
Pinter Pandai “Bersama-Sama Berbagi Ilmu”
Quiz | Matematika | IPA | Geografi & Sejarah | Info Unik | Lainnya | Business & Marketing