Reaksi Asam Basa
Reaksi asam basa adalah reaksi kimia yang melibatkan pereaksi asam dan basa, yang dapat digunakan dalam menentukan pH.
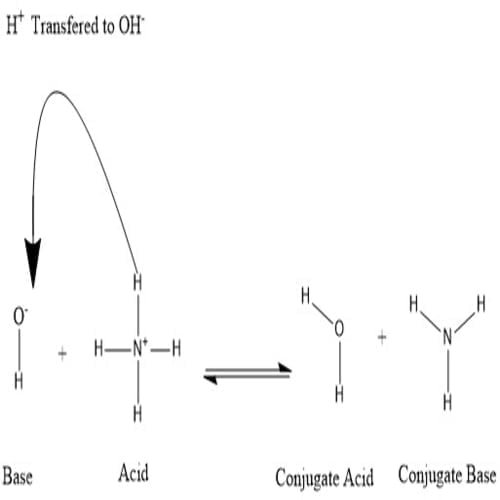
Dalam suatu reaksi asam-basa, asam dan basa membentuk basa konjugat dan asam konjugat:
Konjugat terbentuk saat asam kehilangan proton hidrogen atau basa memperoleh proton hidrogen. Lihat gambar berikut:

Dapat dikatakan bahwa molekul air adalah asam konjugat ion hidroksida setelah hidroksida mendapat proton hidrogen yang diberikan oleh amonium. Di sisi lain, amonia adalah basa konjugat untuk amonium asam setelah amonium telah menyerahkan ion hidrogen untuk menghasilkan molekul air. OH- dapat dianggap sebagai basa konjugat H2O, karena molekul air menyerahkan proton untuk menghasilkan NH+4 dalam reaksi ke arah sebaliknya, yang merupakan proses yang sangat sering terjadi di alam karena basa NH3 lebih kuat dari ion hidroksida.
Berdasarkan informasi ini, dapat dilihat bahwa istilah “asam”, “basa”, “asam konjugat” dan “basa konjugat” bukanlah istilah yang berlaku tetap untuk suatu unsur kimia, tetapi dapat berganti-ganti tergantung pada situasinya.
1. Reaksi Asam-Basa Antara Asam dengan Basa
Didalam Larutan Netralisasi akan terjadi peristiwa antara Asam Kuat dengan Basa Kuat yang mampu menghasilkan persamaan Reaksi Ion dan Persamaan Molekuler dari Reaksi Penetralan (Reaksi Asam dan Basa) Antara Basa Asam dengan Basa tersebut pada umumnya akan menghasilkan Air dan Garam.
ASAM + BASA → GARAM + AIR
Contoh Reaksi Asam dan Basa Antara Asam dengan Basa seperti ini, jika suatu Reaksi antara Larutan Asam Klorida dengan Larutan Natrium Hidroksida maka akan menghasilkan Larutan Garam Natrium Klorida dan Air.
Contoh Soal Reaksi Asam dan Basa Antara Asam dengan Basa.
Soal: Tuliskan Persamaan dari Molekul, Persamaan Ion Lengkap dan Persamaan Ion Bersih untuk Reaksi Asam dan Basa Larutan Asam Nitrat yang ditambahkan dengan Larutan Kalium Hidroksida.
Jawaban:
Persamaan molekul: HNO3(aq) + KOH(aq) → KNO3(aq) + H2O(l)
Persamaan ion lengkap: H+(aq) + NO3-(aq) + K+(aq) + OH-(aq) → K+(aq) → NO3-(aq) + H2O(l)
Persamaan ion bersih: H+(aq) +OH-(aq) → H2O(l)
2. Reaksi Antara Oksida Asam dengan Basa
Pengertian Oksida Asam didalam Ilmu Kimia ialah Oksida Non Logam yang saat dilarutkan ke dalam Air maka akan membentuk Asam dan melepaskan Ion H+. Reaksi Antara Oksida Asam dengan Basa ini akan membentuk Garam dan Air.
OKSIDA ASAM + BASA → GARAM + AIR
Contoh Soal Reaksi Asam-Basa Antara Oksida Asam dengan Basa.
Soal: Reaksi antara Gas Karbon Dioksida dengan Larutan Natrium Hidroksida (CO2 + NaOH).
Jawaban:
Persamaan molekul: CO2(g) + 2NaOH(aq) → Na2CO3(aq) + H2O(l)
Persamaan ion lengkap: CO2(g) + 2Na+(aq) + 2OH-(aq) → 2Na+(aq) + CO32-(aq) + H2O(l)
Persamaan ion bersih: CO2(g) + 2OH-(aq) → CO32-(aq) + H2O(l)
3. Reaksi Antara Asam dengan Oksida Basa
Pengertian Oksida Basa didalam ilmu Kimia ialah suatu Oksida Logam yang saat dilarutkan didalam Air maka akan membentuk Basa dan akan melepaskan Ion H-. Reaksi Antara Asam dengan Oksida Basa tersebut akan membentuk Suatu Garam dan Air seperti dibawah ini :
ASAM + OKSIDA BASA → GARAM + AIR
Contoh Soal Reaksi Antara Asam dengan Oksida Basa.
Soal: carilah Persamaan Molekul, Persamaan Ion Lengkap dan Persamaan Ion Bersih jika Reaksi Antara Asam Bromida dengan Natrium Oksida.
Jawaban:
Persamaan molekul: 2HBr(aq) + Na2O(s) → 2NaBr(aq) + H2O(l)
Persamaan ion lengkap: 2H+(aq) + 2Br-(aq) + Na2O(s) → 2Na+(aq) + 2Br-(aq) + H2O(l)
Persamaan ion bersih: 2H+(aq) + Na2O(s) → 2Na+(aq) + H2O(l)
4. Reaksi Asam-Basa Antara Asam dengan Amonia
Pengertian Amonia didalam ilmu Kimia ialah Basa Lemah yang saat dilarutkan didalam Air maka terbentuk NH4OH dan Reaksi Antara Asam dengan Amonia ini akan menghasilkan Garam Amonium dengan Reaksi seperti dibawah ini :
ASAM + NH3 → GARAM AMONIUM
Contonya Antara Asam dengan Amonia.
Soal: carilah Persamaan Molekul, Persamaan Ion Lengkap dan Persamaan Ion Bersih jika Reaksi Antara Asam Klorida dengan Amnonia (HCI + NH3).
Jawaban:
Persamaan molekul: HCl(aq) + NH3(g) → NH4Cl(aq)
Persamaan ion lengkap: H+(aq) + Cl-(aq) + NH3(g) → NH4+(aq) + Cl-(aq)
Persamaan ion bersih: H+(aq) + NH3(g) → NH4+(aq)
5. Reaksi Antara Oksida Asam dengan Oksida Basa
Jika Reaksi Antara Oksida Asam dengan Oksida basa maka akan terbentuk Garam dengan Reaksi seperti dibawah ini :
OKSIDA ASAM + OKSIDA BASA → GARAM
Contoh Soal Reaksi Antara Oksida Asam dengan Oksida Basa. Soal: tuliskan Persamaan Molekul, Persamaan Ion Lengkap dan Persamaan Ion Bersih jika Reaksi Kalsium Oksida padat direaksikan dengan Gas Belerang Oksida.
Jawaban:
Persamaan molekul: CaO(s) + SO2(g) → CaSO3(g)
Persamaan ion lengkap: CaO(s) + SO2(g) → Ca2+(aq) + SO32-(aq)
Persamaan ion bersih: CaO(s) + SO2(g) → CA2+(aq) + SO32-(aq)

Contoh Soal dan Jawaban Reaksi Asam Basa
1. Reaksi berikut ini yang menghasilkan gas adalah… kecuali.
A. Asam sulfat + natrium hidroksida
B. Ammonium klorida + kalium hidroksida
C. Klorida + besi
D. Natrium karbonat + asam nitrat
E. Aluminium + asam korida
Jawaban: D. Asam sulfat + natrium hidroksida
Karena bereaksi : H2SO4+2NaOHH2SO4+2NaOH→Na2SO4+H2O
2. Tuliskan reaksi: Ammonium klorida + kalium hidroksida
Jawaban:
NH4Cℓ+KOHNH4Cℓ+KOH→KCℓ+NH3+H2O
3. Soal: pH larutan H2SO4 0,01 M adalah…
Jawaban:
H2SO4 → 2H+ + SO2-4
MH+ = 2 x 0,01 M = 0,02 M
pH=-log0,02
=2 -log2
4. Tuliskan reaksi: Ammonium klorida + kalium hidroksida
Jawaban:
2HCℓ+Fe2HCℓ+Fe→FeCℓ2+H2
5. Tuliskan reaksi: Aluminium + asam korida
Jawaban:
Al+6HCℓAl+6HCℓ→2AlCℓ3+3H
6. Reaksi kesetimbangan air murni pada suhu 25°C, 1 atm sebagai berikut: H2O(ℓ)⇌H+(aq)+OH−(aq)ΔH=+(endoterm)
Dengan nilai Kw air murni = 1,0×10−14 sehingga pH air murni = 7. Berikut ini pernyataan yang benar adalah…
Jawaban:
Autoionisasi air merupakan reaksi endoterm, semakin tinggi suhu maka reaksi kesetimbangan autoionisasi air akan bergeser ke arah kanan yang artinya [H+] dan [OH−] bertambah dan nilai Kw bertambah. Sehingga pH+pOH<14 sedangkan konsentrasi ion-ionnya sama, [H+]=[OH−].
7. Suatu larutan dengan pH 5,6 ditambahkan sejumlah air sehingga pHpH larutan berubah menjadi 6,5. Berapakah kali kenaikan konsentrasi H+ sebelum dan sesudah ditambahkan air?
Jawaban:
A. 4
B. 5
C. 6
D. 7
E. 8
Jawaban:
pH=−log[H+
Pada pH 5,6 :=2,51×10−6
Pada pH 6,5 : =3,16×10−7
[H+]pH 5,6[H+]pH 6,5=2,51×10−63,16×10−7=7,94≈8.
Jawaban: E. 8
8. Soal: 21,25 gram padatan NH3 dilarutkan ke dalam air sehingga volumenya 2500 mL. Jika diketahui Kb NH3=1,8×10−5, berapakah pH larutan tersebut?
(ArAr N = 14; H= 1)
A. 0,75%
B. 1,25%
C. 1,5%
D. 1,75%
E. 2,5%
Jawaban:
nnH3 = (21,25 / 17) M = 1,25 M
M NH3 = (1,25 mol / 2,5 L) = 0,5 M
[OH10–] = √1,8×10–5 x 0,5
= √9×10–6
= 3 x 10–3
[OH10–] = M x α
α = (3 x 10–3 / 0,2) = 0,015 = 1,5%
Bacaan Lainnya
- Jenis Senyawa : Asam, Basa, Ionik, Garam, Oksida dan Organik
- Asam Basa pH – Rumus Kimia, Penjelasan, Contoh Soal dan Jawaban
- Asam Basa Konjugat – Konjugasi Asam Basa & Rumus, Konjugat, Contoh Soal dan Jawaban
- pH Derajat Keasaman, p[H], pOH – Rumus, Soal dan Jawaban
- Rumus Kimia Konsep Mol Dan Empiris Beserta Contoh Soal Dan Jawaban
- Contoh Soal Rumus Kimia Garam Dan Jawabannya
- Surfaktan Senyawa Organik – Penjelasan, Contoh Soal dan Jawaban
- Rumus Usaha Fisika – Bersama Contoh Soal dan Jawaban
- Rumus Foton (Kuanta Cahaya) Fisika Contoh Soal dan Jawaban
- Tabel Konstanta Fisika – Tabel konstanta universal, elektromagnetik, atom dan nuklir, fisika-kimia, nilai yang diadopsi, satuan natural, bilangan tetap
- Rumus Kimia Konsep Mol Dan Empiris Beserta Contoh Soal Dan Jawaban
- Surfaktan Senyawa Organik – Penjelasan, Contoh Soal dan Jawaban
- Nama Obat dan Untuk Penyakit Apa ? – Daftar Nama Obat Esensial diterbitkan oleh Organisasi Kesehatan Dunia (WHO)
- Fraksi Mol Kimia”Xi” – Rumus, Penjelasan, Contoh Soal dan Jawaban
- Bagaimana Laut Mati / Dead Sea Mendapatkan Namanya? Mengapa Anda Dapat Mengapung Di Laut Mati?
- 10 Kegiatan Yang Akan Membantu Otak Anda Menjadi Tetap Muda Dan Tajam
- Jaringan tumbuhan yang berfungsi mengangankut air, dari akar ke daun adalah?
- Penyakit Alzheimer – Apa yang Terjadi di Otak?
- Apa Yang Terjadi Pada Saat Otak Kita Membeku?
- Sifat (perilaku) dapat dirubah. Tetapi watak (karakter) tidak dapat. Setuju ???
- Ternyata, jatuh cinta sebabkan perubahan kimiawi pada otak – hormon serotonin
- Cara Berciuman – Tips, Nasihat Dan Langkah Untuk Ciuman Pertama Yang Sempurna
- 7 Cara Untuk Menguji Apakah Dia, Adalah Teman Sejati Anda Atau Bukan BFF (Best Friend Forever)
- Kepalan Tangan Menandakan Karakter Anda – Kepalan nomer berapa yang Anda miliki?
Unduh / Download Aplikasi HP Pinter Pandai
Respons “Ooo begitu ya…” akan sering terdengar jika Anda memasang applikasi kita!
Siapa bilang mau pintar harus bayar? Aplikasi Ilmu pengetahuan dan informasi yang membuat Anda menjadi lebih smart!
Sumber bacaan: Britannica, Science Direct, LibreTexts, Elementalmatter
Pinter Pandai “Bersama-Sama Berbagi Ilmu”
Quiz | Matematika | IPA | Geografi & Sejarah | Info Unik | Lainnya | Business & Marketing
