Definisi pH Derajat Keasaman
pH derajat keasaman didefinisikan sebagai minus logaritma dari aktivitas ion hidrogen dalam larutan berpelarut air.
Rumus pH derajat keasaman merupakan kuantitas tak berdimensi
dengan aH adalah aktivitas ion hidrogen. Alasan penggunaan definisi ini adalah bahwa aH dapat diukur secara eksperimental menggunakan elektrode ion selektif yang merespon terhadap aktivitas ion hidrogen ion.
pH umumnya diukur menggunakan elektrode gelas yang mengukur perbedaan potensial E antara elektrode yang sensitif dengan aktivitas ion hidrogen dengan elektrode referensi.
Perbedaan potensial pada elektrode gelas ini idealnya mengikuti persamaan Nernst:
dengan E adalah potensial terukur, E0 potensial elektrode standar, R tetapan gas, T temperatur dalam kelvin, F tetapan Faraday, dan n adalah jumlah elektron yang ditransfer. Potensial elektrode E berbanding lurus dengan logartima aktivitas ion hidrogen.
Definisi ini pada dasarnya tidak praktis karena aktivitas ion hidrogen merupakan hasil kali dari konsentrasi dengan koefisien aktivitas. Koefisien aktivitas ion hidrogen tunggal tidak dapat dihitung secara eksperimen. Untuk mengatasinya, elektrode dikalibrasi dengan larutan yang aktivitasnya diketahui.
Definisi operasional pH secara resmi didefinisikan oleh Standar Internasional ISO 31-8 sebagai berikut:
Untuk suatu larutan X, pertama-tama ukur gaya elektromotif EX sel galvani
- elektrode referensi | konsentrasi larutan KCl || larutan X | H2 | Pt
dan kemudian ukur gaya elektromotif ES sel galvani yang berbeda hanya pada penggantian larutan X yang pHnya tidak diketahui dengan larutan S yang pH-nya (standar) diketahui pH(S). pH larutan X oleh karenanya
Perbedaan antara pH derajat keasaman larutan X dengan pH larutan standar
Perbedaan antara pH larutan X dengan pH larutan standar bergantung hanya pada perbedaan dua potensial yang terukur. Sehingga, pH didapatkan dari pengukuran potensial dengan elektrode yang dikalibrasikan terhadap satu atau lebih pH standar.
Alat pengukur pH
Suatu pH meter diatur sedemikiannya pembacaan meteran untuk suatu larutan standar adalah sama dengan nilai pH(S). Nilai pH(S) untuk berbagai larutan standar S diberikan oleh rekomendasi IUPAC {Persatuan Internasional Kimia Murni dan Terapan (bahasa Inggris: International Union of Pure and Applied Chemistry; IUPAC)}.

Larutan standar yang digunakan sering kali merupakan larutan penyangga standar.
Dalam praktiknya, adalah lebih baik untuk menggunakan dua atau lebih larutan penyangga standar untuk mengizinkan adanya penyimpangan kecil dari hukum Nerst ideal pada elektrode sebenarnya. Oleh karena variabel temperatur muncul pada persamaan di atas, pH suatu larutan bergantung juga pada temperaturnya.
Pengukuran nilai pH derajat keasaman yang sangat rendah
Misalnya pada air tambang yang sangat asam, memerlukan prosedure khusus. Kalibrasi elektrode pada kasus ini dapat digunakan menggunakan larutan standar asam sulfat pekat yang nilai pH-nya dihitung menggunakan parameter Pitzer untuk menghitung koefisien aktivitas.
pH derajat keasaman merupakan salah satu contoh fungsi keasaman. Konsentrasi ion hidrogen dapat diukur dalam larutan non-akuatik, namun perhitungannya akan menggunakan fungsi keasaman yang berbeda. pH superasam biasanya dihitung menggunakan fungsi keasaman Hammett, H0.
Umumnya indikator asam-basa sederhana yang digunakan adalah kertas lakmus yang berubah menjadi merah bila keasamannya tinggi dan biru bila keasamannya rendah
Selain menggunakan kertas lakmus, indikator asam basa dapat diukur dengan pH meter yang bekerja berdasarkan prinsip elektrolit / konduktivitas suatu larutan.
p[H]
Menurut definisi asli Sørensen, p[H] didefinisikan sebagai minus logaritma konsentrasi ion hidrogen. Definisi ini telah lama ditinggalkan dan diganti dengan definisi pH. Adalah mungkin untuk mengukur konsentrasi ion hidrogen secara langsung apabila elektrode yang digunakan dikalibrasi sesuai dengan konsentrasi ion hidrogen.
Salah satu caranya adalah dengan mentitrasi larutan asam kuat yang konsentrasinya diketahui dengan larutan alkali kuat yang konsentrasinya juga diketahui pada keberadaan konsentrasi elektrolit latar yang relatif tinggi.
Oleh karena konsentrasi asam dan alkali diketahui, adalah mudah untuk menghitung ion hidrogen sehingga potensial yang terukur dapat dikorelasikan dengan kosentrasi ion. Kalibrasi ini biasanya dilakukan menggunakan plot Gran.
Kalibrasi ini akan menghasilkan nilai potensial elektrode standar, E0, dan faktor gradien, f, sehingga persamaan Nerstnya berbentuk
Persamaan ini dapat digunakan untuk menurunkan konsentrasi ion hidrogen dari pengukuran eksperimental E. Faktor gradien biasanya lebih kecil sedikit dari satu. Untuk faktor gradien kurang dari 0,95, ini mengindikasikan bahwa elektrode tidak berfungsi dengan baik.
Keberadaan elektrolit latar menjamin bahwa koefisien aktivitas ion hidrogen secara efektif konstan selama titrasi. Oleh karena ia konstan, maka nilainya dapat ditentukan sebagai satu dengan menentukan keadaan standarnya sebagai larutan yang mengandung elektrolit latar.
Dengan menggunakan prosedur ini, aktivitas ion akan sama dengan nilai konsentrasi.
Perbedaan antara p[H] dengan pH biasanya cukup kecil. Dinyatakan bahwa pH = p[H] + 0,04. Pada praktiknya terminologi p[H] dan pH sering dicampuradukkan dan menyebabkan kerancuan.
pOH
pOH kadang-kadang digunakan sebagai satuan ukuran konsentrasi ion hidroksida OH−. pOH tidaklah diukur secara independen, namun diturunkan dari pH derajat keasaman.
Konsentrasi ion hidroksida dalam air berhubungan dengan konsentrasi ion hidrogen berdasarkan persamaan
[OH−] = KW /[H+]
dengan KW adalah tetapan swaionisasi air. Dengan menerapkan kologaritma:
pOH = pKW − pH.
Sehingga, pada suhu kamar pOH ≈ 14 − pH. Namun hubungan ini tidaklah selalu berlaku pada keadaan khusus lainnya.
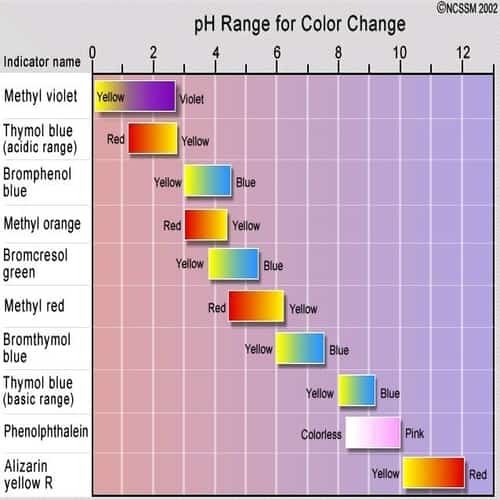 Rentang pH derajat keasaman untuk perubahan warna.
Rentang pH derajat keasaman untuk perubahan warna.
Indikator asam / basa adalah zat kimia yang berubah warna tergantung pada apakah larutan bersifat asam atau asam basa. Ada banyak indikator berbeda yang tersedia yang berubah dari satu warna ke warna lainnya – semakin tajam warnanya berubah semakin mudah untuk melihat apakah ada sesuatu yang asam atau basa.
Tabel di bawah ini menunjukkan perubahan warna yang terjadi untuk sejumlah indikator berbeda. Sumber foto: Science
Cara Menentukan, Menghitung pH derajat keasaman dan POH Larutan, Sifat Asam dan Basa, Indikator, Contoh Soal, Pembahasan, Kimia
Cara Menentukan, Menghitung pH dan POH Larutan, Sifat Asam dan Basa, Indikator, Contoh Soal, Pembahasan, Kimia – Apakah suatu larutan bersifat asam atau basa dapat kita ketahui kalau kita mempunyai alat untuk mendeteksinya. Dalam pendeteksian ini, ada beberapa alat yang dapat digunakan. Agar kalian tahu lebih jelas tentang alat itu, simak penjelasan.
1. Konsep pH (Derajat Keasaman)
Dari uraian tetapan kesetimbangan air dapat disimpulkan bahwa besarnya [H+] dalam suatu larutan merupakan salah satu ukuran untuk menentukan tingkat keasaman suatu larutan.
Untuk menyatakan tingkat atau derajat keasaman suatu larutan, pada tahun 1910, seorang ahli dari Denmark, Soren Lautiz Sorensen memperkenalkan suatu bilangan yang sederhana. Bilangan ini diperoleh dari hasil logaritma konsentrasi H+.
Bilangan ini kita kenal dengan skala pH. Harga pH berkisar antara 1 – 14 dan ditulis:
pH = – log [H+]
Analog dengan di atas, maka:
pOH = – log [OH–]
Sedangkan hubungan antara pH dan pOH adalah:
Kw = [H+] [OH–] – log Kw = –log [H+] + (–log [OH–])
pKw = pH + pOH
Pada suhu 25 ºC, pKw = pH + pOH = 14.
Dari uraian di atas dapat kita simpulkan bahwa:
a. Larutan bersifat netral jika [H+] = [OH–] atau pH = pOH = 7.
b. Larutan bersifat asam jika [H+] > [OH–] atau pH < 7.
c. Larutan bersifat basa jika [H+] < [OH–] atau pH > 7.
Karena pH dan konsentrasi ion H+ dihubungkan dengan tanda negatif, maka makin besar konsentrasi ion H+ makin kecil pH, dan karena bilangan dasar logaritma adalah 10, maka larutan yang nilai pH-nya berbeda sebesar n mempunyai perbedaan ion H+ sebesar 10n.
Perhatikan contoh di bawah ini.
Jika konsentrasi ion H+ = 0,01 M, maka pH = – log 0,01 = 2
Jika konsentrasi ion H+ = 0,001 M (10 kali lebih kecil)
maka pH = – log 0,001 = 3 (naik 1 satuan)
Jadi dapat disimpulkan:
• Makin besar konsentrasi ion H+ makin kecil pH
• Larutan dengan pH = 1 adalah 10 kali lebih asam daripada larutan dengan pH = 2.
2. Cara Menunjukan Sifat Asam dan Basa dengan Menggunakan Indikator
Sifat asam dan basa dapat diketahui dengan mencicipinya, namun amat berbahaya untuk zat-zat kimia di laboratorium. Selain dengan mencicipi, kita juga dapat mengetahui sifat asam atau basa dari pengaruhnya terhadap indikator.
Indikator adalah suatu zat kimia yang warnanya tergantung pada keasaman atau kebasaan larutan. Indikator yang biasa digunakan adalah kertas lakmus.
Apabila dicelupkan ke dalam larutan basa, kertas lakmus merah akan berubah warna menjadi biru, sedangkan kertas lakmus biru akan berwana merah jika dicelupkan ke dalam larutan asam.
Warna lakmus semakin merah tua dengan nilai pH derajat keasaman semakin kecil, sedangkan warna lakmus semakin biru tua dengan nilai pH semakin besar, meskipun konsentrasi larutannya sama. Hal ini menunjukkan kekuatan asam dan basa tiap-tiap larutan berbeda.
pH Meter
PH meter adalah sebuah alat elektronik yang berfungsi untuk mengukur pH (derajat keasaman atau kebasaan) suatu cairan (ada elektroda khusus yang berfungsi untuk mengukur pH bahan-bahan semi-padat). Sebuah pH meter terdiri dari sebuah elektroda (probe pengukur) yang terhubung ke sebuah alat elektronik yang mengukur dan menampilkan nilai pH. alat ini sangat berguna untuk industri air minum, laboratorium, akuarium, industri pakaian terutama batik dan pewarna pakaian
2.1. Menggunakan Beberapa Indikator
Indikator adalah asam organik lemah atau basa organik lemah yang dapat berubah warna pada rentang harga pH tertentu (James E. Brady, 1990). Harga pH suatu larutan dapat diperkirakan dengan menggunakan trayek pH indikator. Indikator memiliki trayek perubahan warna yang berbeda-beda. Dengan demikian dari uji larutan dengan beberapa indikator akan diperoleh daerah irisan pH larutan.
Contoh, suatu larutan dengan brom timol biru (6,0 – 7,6) berwarna biru dan dengan fenolftalein (8,3 – 10,0) tidak berwarna, maka pH larutan itu adalah 7,6–8,3. Hal ini disebabkan jika brom timol biru berwarna biru, berarti pH larutan lebih besar dari 7,6 dan jika dengan fenolftalein tidak berwarna, berarti pH larutan kurang dari 8,3.
2.2. Menggunakan Indikator Universal
pH suatu larutan juga dapat ditentukan dengan menggunakan indikator universal, yaitu campuran berbagai indikator yang dapat menunjukkan pH suatu larutan dari perubahan warnanya. Warna indikator universal larutan dapat dilihat pada tabel 1.
Tabel 1. Warna indikator universal pada berbagai pH
| pH | Warna Indikator Universal | pH | Warna Indikator Universal |
| 1 | merah | 8 | biru |
| 2 | merah lebih muda | 9 | biru muda |
| 3 | merah muda | 10 | ungu sangat muda |
| 4 | merah jingga | 11 | ungu muda |
| 5 | jingga | 12 | ungu tua |
| 6 | kuning | 13 | ungu tua |
| 7 | hijau | 14 | ungu tua |
2.3. Menggunakan pH–meter
pH–meter adalah alat pengukur pH dengan ketelitian yang sangat tinggi.
3. Cara Menghitung pH Larutan
Telah dijelaskan sebelumnya bahwa sifat asam suatu larutan ditentukan oleh adanya ion H+ yang ada pada senyawa ketika dilarutkan dalam air. Dengan demikian, tingkat keasaman suatu larutan tergantung pada konsentrasi ion H+ tersebut. Sebagai contoh, larutan 0,01M HCI akan terionisasi menjadi:
| HCI(aq) | → | H+(aq) | + | CI–(aq) |
| 0,01 M | 0,01 M | 0 ,01 M |
Konsentrasi ion H+ di atas 0,01 M. Konsentrasi ini didapatkan dari perbandingan koefisien, di mana koefisien H+ = koefisien HCl, sehingga konsentrasi ion H+ = konsentrasi HCI = 0,01 M.
Larutan 0,01 M HCI sering ditulis dengan larutan pH 2 bukan larutan pH 0,01; padahal konsentrasi ion H+-nya 0,01 M. Mengapa demikian?
Konsentrasi ion H+ seringkali memiliki nilai yang kecil sehingga seorang ilmuwan kimia dari Denmark yang bernama Sorensen mengusulkan untuk penulisan tingkat keasaman suatu larutan ditulis dengan pH agar menyatakan konsentrasi ion H+. Nilai pH sama dengan negatif logaritma konsentrasi ion H+. Secara matematis, untuk mencari pH suatu larutan dirumuskan sebagai berikut.
pH = -log [H+]
Dan perumusan di atas, maka pH larutan dapat dicari dengan perhitungan berikut.
pH 0,01 M HCI = -log 1 x 10-2 = 2
Dan uraian di atas dapat disimpulkan bahwa semakin besar konsentrasi larutannya, maka nilai pH-nya semakin kecil dan tingkat keasamannya bertambah besar. Begitu pula sebaliknya, semakin kecil konsentrasi larutan, semakin besar nilai pH nya.
4. Cara Menghitung pOH Larutan
Untuk mencari pOH suatu larutan basa, caranya sama dengan mencari pH larutan asam. Analog dengan pH, konsentrasi ion OH– dapat ditulis dengan pOH sehingga diperoleh persamaan berikut.
pOH = – log [OH–]
Contoh soal berikut akan membuat kalian lebih paham.
Contoh Soal Menentukan nilai POH:
Berapakah pOH larutan NaOH 0,01M ?
Jawab:
Jika dilarutkan dalam air, larutan NaOH akan mengalami ionisasi sebagai berikut.
| NaOH (aq) | → | Na+(aq) | + | OH–(aq) |
| 0,01 M | 0,01 M | 0 ,01 M |
Koefisien OH- sama dengan koefisien NaOH, sehingga konsentrasi ion OH– juga sama, yaitu 0,01 M dan pOHnya = -log 1 x 10-2 =2.
Jadi, pOH larutan NaOH adalah 2.
5. Kesetimbangan Air
Air sumur yang terasa tawar memiliki nilai pH = 7 atau bersifat netral. Mengapa demikian? Setelah diteliti dan diukur, ternyata air murni mengandung ion dalam jumlah yang kecil sekali.
Hal ini disebabkan terjadinya reaksi asam basa sesama molekul air dan membentuk kesetimbangan berikut ini.
H2O(l) D H+(aq) + OH–(aq)
Menurut hukum kesetimbangan, maka Kc =
Karena derajat disosiasi (α) air sangat kecil, maka jumlah air yang terionisasi dapat diabaikan sehingga konsentrasi air yang tidak terionisasi dapat dianggap konstan. Persamaan kesetimbangan di atas menjadi :
- Kc [H2O] = [H+] [OH–]
- Kc [H2O] = Kw
- sehingga dapat ditulis : Kw = [H+] . [OH–]
Kw adalah konstanta ionisasi air pada suhu kamar (25° C) dan mempunyai nilai 10-14, sehingga dalam air murni terdapat ion-ion dengan konsentrasi berikut.
- 10-14 = [H+] [OH–]
- [H+] = [OH–] = 10-7
- pH = -log 10-7 = 7
- Jadi, air memiliki pH 7 atau netral.
Dalam persamaan kesetimbangan di atas, tertulis konsentrasi H+ dan OH–. [H+] dapat dinyatakan dengan pH dan [OH–] dapat dinyatakan dengan pOH. Adakah hubungan antara pH dengan pOH? Simak uraian berikut.
6. Hubungan pH derajat keasaman dengan pOH
Nilai Kw = 10-14 tidak hanya untuk air murni, tetapi juga berlaku untuk larutan asam atau basa karena adanya kesetimbangan ion. Perhatikan reaksi
H2O(l) → H+(aq) + OH–(aq)
Jika larutan mengandung asam, berarti menambah jumlah H+ dan akan menggeser kesetimbangan ke kiri sampai tercapai kesetimbangan baru Pada kesetimbangan baru jumlah konsentrasi H+ lebih besar daripada konsentrasi OH–, tetapi hasil perkalian [H+] dan [OH–] tetap 10-14. Hal yang sama akan terjadi jika air ditambah basa sehingga dicapai kesetimbangan baru dengan nilai [OH–] > [H+] dan hasil perkaliannya pun tetap 10-14.
Berdasarkan perbedaan jumlah konsentrasi ion H+ dan OH–, maka larutan dapat dibagi menjadi tiga, yaitu:
- Larutan asam : [H+] > [OH–]
- Larutan netral : [H+] = [OH–] = 10-7
- Larutan basa : [H+] < [OH–]
Dari reaksi kesetimbangan air ini diperoleh:
Kw = [H+] x [OH–]
Apabila diambil dalam bentuk harga negatif, logaritma persamaan di atas menjadi sebagai berikut.
– log Kw = -log ([H+] . [OH–])
– log Kw = -log [H+] + (-log [OH–]) dengan p = – log
Sesuai rumus matematika,
log ( a x b ) = log a + log b
Pada suhu kamar (25 °C), pKw = 14 sehingga pH + pOH = 14.
Untuk lebih sederhananya, penentuan larutan bersifat asam, basa, atau netral dapat dituliskan seperti di bawah ini.
| No. | Sifat Larutan | pH | pOH |
| 1. | Asam | < 7 | >7 |
| 2. | Basa | > 7 | < 7 |
| 3. | Netral | 7 | 7 |
Agar lebih paham dengan penjelasan di atas, perhatikan contoh soal berikut.
Contoh Soal:
Berapa pH larutan berikut (diketahui log 2 = 0,301)?
- HCl 0,2 M
- NaOH 0,1 M
Penyelesaian:
- Diketahui :
Log 2 = 0,301
Ditanyakan : pH = …. ?
Jawaban :
| HCl | → | H+ | + | Cl– |
| 0,02 M | 0,02 M | 0 ,02 M |
Koefisien HCl = koefisien H+ sehingga
[H+] = [HCl] = 0,2 Mmaka
pH = -log [H+] = -log 2 x 10-1 = 1 – log 2 = 1 – 0,301 = 0,691
Jadi, pH larutan HCl 0,2 M adalah 0,691.
- Diketahui :
Ditanyakan : pH = …. ?
Jawaban :
| NaOH(aq) | → | Na+(aq) | + | OH–(aq) |
| 0,01 M | 0,02 M | 0 ,01 M |
Koefisien OH– = koefisien NaOH sehingga :
[OH–] = [NaOH] = 0,1maka pOH = -log [OH–] = -log 10-1 = 1
pH = 14 – pOH = 14 – 1 = 13
Jadi, pH larutan NaOH 0,1 M adalah 13.
Dari contoh soal yang telah dibahas, kita dapat mengetahui bahwa harga kekuatan asam dan basa ditentukan oleh besar kecilnya konsentrasi ion H+ dalam larutan. Semakin besar konsentrasi ion H+ dalam larutan, semakin kecil harga pH-nya. Begitu pula sebaliknya, semakin besar konsentrasi ion OH– dalam larutan, semakin kecil konsentrasi ion H+, sehingga semakin kecil harga pH-nya.
Larutan elektrolit akan terionkan dalam air menjadi ion-ionnya. Sewaktu pengionan, belum tentu semua zat terionkan. Ada sebagian zat yang terionkan sempurna, ada yang terionkan sebagian besar, dan ada pula yang terionkan sebagian kecilnya saja. Apakah besarnya pengionan ini mempengaruhi pH larutan? Simak materi berikut, dan kalian akan tahu jawabannya.
Contoh Soal Menghitung pH derajat keasaman larutan:
Hitunglah pH larutan berikut.
a. H2SO4 0,04 M
b. CH3COOH 0,1 M (Ka = 10–5)
c. Ca(OH)2 0,3 M
d. NH4OH 0,1 M (Kb = 10–5)
Jawaban :
a. H2SO4 0,04 M
Asam sulfat adalah asam kuat, mengion sempurna.
H2SO4 → 2H+ + SO42–
[H+] = x . [HA] = 2 . 0,04 = 0,08 M
pH = – log 0,08
pH = 2 – log 8
b. CH3COOH 0,1 M (Ka = 10−5)
CH3COOH D Η+ + CH3COO–
[Η+] =[Η+] =
[Η+] =
[Η+] = 10−3 M
pH = 3
c. Ca(OH)2 0,3 M
Ca(OH)2 → Ca2+ + 2OH–
[OH–] = x . [M(OH)] = 2 . 0,3 = 0,6 MpOH = 1 – log 6
pH = 14 – pOH = 14 – (1–log 6) = 13 + log 6
d. NH4OH 0,1 M (Kb = 10−5)
NH4OH D NH4+ + OH–
[OH–] =[OH–] =
[OH–] = 10−3 M
pOH = 3
pH = 14 – pOH = 14 – 3 = 11
7. Percobaan / Praktikum Mengukur pH Larutan
Ingatlah, bahwa untuk mengetahui sifat asam atau basa suatu larutan dapat dilakukan dengan menggunakan indikator. Salah satu contoh indikator yang sudah kalian ketahui adalah kertas lakmus.
Suatu indikator bekerja pada trayek pH tertentu dan akan memberikan suatu warna gradasi disekitat trayek pH tersebut. Sebagai contoh indikator bromtimol biru yang memiliki trayek pH antara 6,0 – 7,6 dengan perubahan warna indikator dari kuning menjadi biru.
Bagaimanakah jika larutan yang ditetesi dengan indikator itu tidak memberikan warna? Berapakah pH larutan tersebut? Bagimanakah cara kita menentukan pH-nya? Untuk itu diperlukan beberapa indikator sehingga pH larutan dapat ditentukan. Agar kalian lebih paham lakukanlah kegiatan di rubrik Aktivitas berikut.
A. Dasar Teori
lndikator adalah alat untuk mengetahui apakah larutan bersifat asam atau basa. lndikator merupakan zat warna larut yang perubahan warnanya tampak jelas dalam rentang pH yang sempit. lndikator yang baik mempunyai intensitas warna sedemikian rupa sehingga untuk mengetahui perubahan pH pada larutan uji hanya memerlukan beberapa tetes indikator encer.
Konsentrasi indikator yang sangat rendah ini hampir tidak berpengaruh terhadap pH larutan.
Ada berbagai macam indikator, mulai dari yang sintetis sampai zat pewarna alami yang ditemukan pada buah buahan, sayur-sayuran, dan bunga. Beberapa indikator sintetis dan jangkauan warnanya dapat dilihat pada tabel berikut.
Tabel Jangkauan Warna Beberapa Indikator
| Indikator | Perubahan Warna | Trayek pH |
| metil merah | merah ke kuning | 4,2 – 6,2 |
| metil jingga | merah ke kuning | 3,1 – 4,4 |
| fenolftalin | tak berwarna ke merah ungu | 8,0 – 9,6 |
| ekstrak kol merah | merah-ungu-kuning | |
| Sumber : Oxtoby, 2001, hlm. 304 (dengan pengembangan). | ||
B. Tujuan Percobaan
Memperkirakan pH suatu larutan menggunakan beberapa indikator
C. Alat dan Bahan
Alat :
- Erlenmeyer 25 mL
- Gelas ukur 20 mL
- Pipet tetes
Bahan :
- Air sabun
- Air sumur
- Air jeruk
- Air kapur
- Larutan cuka
- lndikator metil merah
- lndikator metil jingga
- Indikator fenolftalein
D. Langkah Percobaan
1. Ambillah 20 mL larutan sabun, kemudian tuangkan ke dalam tiga erlenmeyer.
2. Tambahkan ke dalam masing-masing erlenmeyer tersebut 2 tetes indikator berturut-turut.
▪ erlenmeyer 1 dengan metil merah
▪ erlenmeyer 2 dengan metil jingga
▪ erlenmeyer 3 dengan fenolftalein
3. Amati perubahan warna yang terjadi dan catatlah.
4. Lakukan langkah percobaan seperti 1-3 terhadap larutan lainnya.
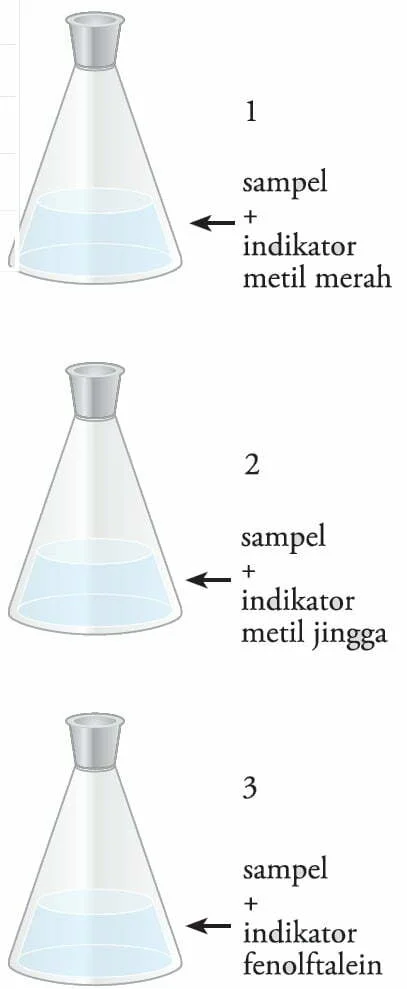
E. Hasil Percobaan
Isilah tabel berikut ini sesuai dengan hasil pengamatan.
| No. | Larutan | Perubahan Warna yang Terjadi | ||
| Metil Merah | Metil Jingga | Fenolftalein | ||
| 1. | air sabun | |||
| 2. | air jeruk | |||
| 3. | air kapur | |||
| 4. | larutan cuka | |||
| 5. | air sumur | |||
F. Pembahasan
Dari hasil pengamatan yang telah kalian lakukan, jawablah pertanyaan-pertanyaan berikut.
- Perkirakanlah pH dari masing-masing larutan. Kalian bisa melihat tabel indikator dan jangkauan warnanya pada dasar teori untuk membantu menentukan pH larutan.
- Klasifikasikan larutan-larutan tersebut ke dalam golongan asam, basa, atau netral.
- Bagaimana sifat-sifat asam dan basa berdasarkan percobaan ini?
Kesimpulan
Diskusikan hasil percobaan dengan kelompok kalian dan tuliskan dalam laporan kegiatan.
Dari hasil kegiatan di atas, kita bisa mengetahui bahwa untuk menentukan
pH suatu larutan tidak bisa hanya menggunakan 1 indikator. Minimal
kita membutuhkan dua indikator. Sebagai penjelas, coba perhatikan
contoh penentuan pH berikut.
Contoh :
Suatu larutan setelah ditetesi dengan metil merah (4,2 – 6,3/merahkuning) memberikan warna kuning, sedangkan setelah ditetesi fenolftalein (8,3-9,6/tak berwarna-merah) tak bewarna. Berapakah pH larutan tersebut? Terangkan.
Pembahasan:
Saat ditetesi metil jingga, larutan itu berwarna kuning sehingga pH > 6,3. Saat ditetesi fenolftalein tak berwarna, sehingga pH < 8,3. Dari perubahan yang terjadi setelah ditetesi dua indikator, maka pH larutan tersebut adalah 6,3 < pH < 8,3.
Dengan mengetahui konsentrasi larutan, kita akan tahu pH suatu larutan secara tepat. Pengukuran pH dilakukan pada larutan asam maupun basa. Apabila larutan asam ditambahkan pada larutan basa, maka akan terjadi suatu reaksi.
Bacaan Lainnya
- Entalpi Termokimia – Pemanasan / Kalor Fisika – Soal dan Jawaban
- Termokimia – Rumus, Penjelasan Beserta Contoh Soal dan Jawaban
- Tabel Periodik Lengkap Dengan Daftar Unsur Kimia Berdasarkan Nama, Warna dan Jenis
- Unsur, Senyawa dan Campuran Kimia – Beserta Penjelasan & Rumus
- Rumus Fisika: Alat optik: Lup, Mikroskop, Teropong Bintang, Energi, Frekuensi, Gaya, Gerak, Getaran, Kalor, Massa jenis, Medan magnet, Mekanika fluida, Momen Inersia, Panjang gelombang, Pemuaian, Percepatan (akselerasi), Radioaktif, Rangkaian listrik, Relativitas, Tekanan, Usaha Termodinamika, Vektor
- Bagaimana Albert Einstein mendapatkan rumus E=mc² ?
- Cara Mengemudi Aman Pada Saat Mudik atau Liburan Panjang
Sumber bacaan: ThoughtCo, Britannica




![{\displaystyle E=E^{0}+f{\frac {RT}{nF}}\log _{e}[{\mbox{H}}^{+}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/85584d1ffca5ec688288b919f844534e2658c011)