Termokimia
Termokimia adalah cabang kimia yang berhubungan dengan hubungan timbal balik panas dengan reaksi kimia atau dengan perubahan keadaan fisika.
Secara umum, termokimia adalah penerapan termodinamika untuk kimia. Termokimia ialah sinonim dari termodinamika kimia.
Tujuan utama termokimia
Adalah pembentukan kriteria untuk ketentuan penentuan kemungkinan terjadi atau spontanitas dari transformasi yang diperlukan.
Dengan cara ini, termokimia digunakan memperkirakan perubahan energi yang terjadi dalam proses-proses berikut:
- Reaksi kimia
- Perubahan fase
- Pembentukan larutan
Ciri-ciri termokimia
Sebagian besar ciri-ciri dalam termokimia berkembang dari penerapan hukum I termodinamika, hukum ‘kekekalan’ energi, untuk fungsi keadaan berikut ini.
- Energi dalam (U)
- Entalpi (H).
- Entropi (S)
- Energi bebas Gibbs (G)
Proses termokimia
Suatu sistem mengalami proses ketika satu atau lebih propertinya berubah. Suatu proses berkaitan dengan perubahan negara. Proses isotermal (suhu-sama) terjadi ketika suhu sistem tetap konstan.
Proses isobarik (tekanan yang sama) terjadi ketika tekanan sistem tetap konstan. Suatu proses bersifat adiabatik ketika tidak terjadi pertukaran panas.
3 Macam Sistem Interaksi Termokimia
Berdasarkan interaksinya dengan lingkungan, sistem digolongkan menjadi tiga jenis, yaitu sistem terbuka, sistem tertutup, dan sistem terisolasi atau tersekat.
1. Sistem Terbuka
Sistem terbuka memungkinkan terjadinya pertukaran kalor dan materi antara sistem dan lingkungan. Contoh sistem terbuka adalah reaksi pemanasan kalium karbonat dalam gelas beker.
2. Sistem Tertutup
Sistem tertutup adalah suatu sistem yang memungkinkan terjadinya pertukaran kalor antara sistem dan lingkungannya, tetapi tidak terjadi pertukaran materi. Contoh sistem tertutup adalah reaksi antara batu kapur dengan air dalam erlenmeyer yang ditutup.
3. Sistem Terisolasi atau Tersekat
Pada sistem terisolasi, tidak mungkin terjadi pertukaran kalor dan materi antara sistem dengan lingkungan. Contoh sistem terisolasi adalah air dalam termos.
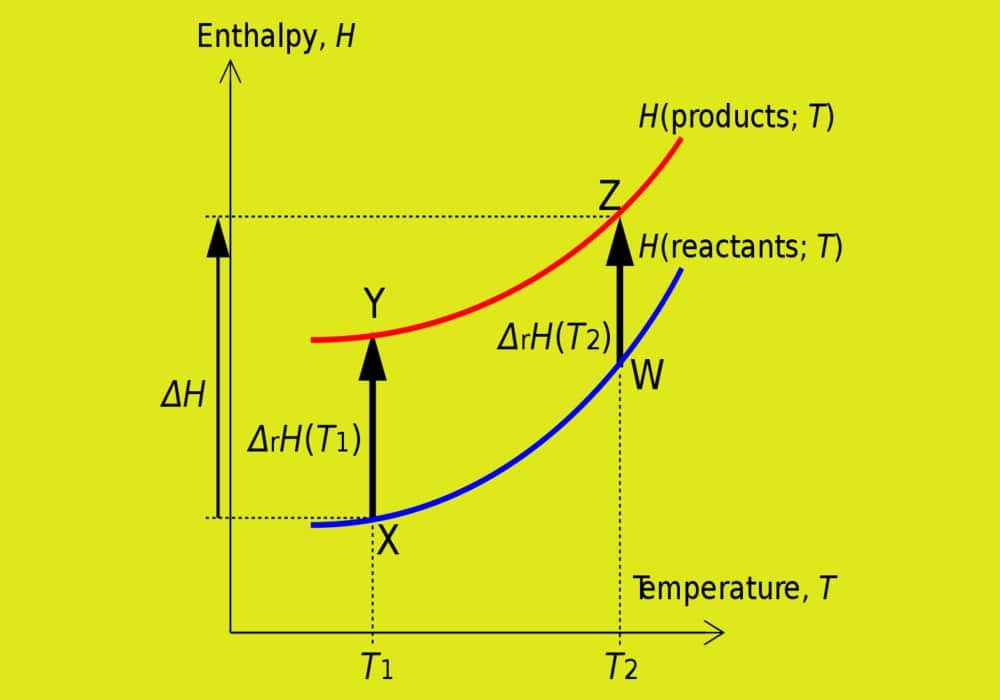
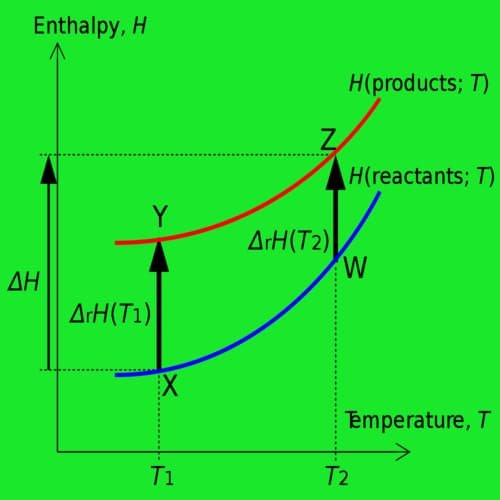
Entalpi adalah keseluruhan energi dalam bentuk kalor yang terdapat dalam suatu sistem. Entalpi dalam sistem bersifattetap selama tidak terjadi pertukaran energi antara sistem dengan lingkungan. Entalpi dinyatakan dengan huruf H dengan satuan joule (J).
Besarnya entalpi tidak dapat ditentukan, yang dapat ditentukan adalah perubahannya, dinyatakan dengan ΔH.
Perubahan entalpi (ΔH) yaitu perubahan kalor yang terjadi pada suatu reaksi kimia. Besarnya perubahan entalpi diperoleh dari selisih antara entalpi produk dengan entalpi reaktan.
Hukum Termokimia
Terdapat beberapa hukum yang mengatur tentang konteks dari ilmu termokimia, salah satunya yang paling utama ialah Hukum Kekekalan Energi.
Dalam hukum kekekalan energi dinyatakan bahwa “energi tidak dapat diciptakan atau dimusnahkan, energi hanya dapat diubah”.
Berdasarkan pernyataan tersebut, kita dapat menyimpulkan bahwa dalam setiap reaksi kimia sebenarnya hanya terjadi pelepasan atau penyerapan energi, pelepasan energi yang dihasilkan oleh suatu reaksi kimia bukan berarti reaksi kimia tersebut menciptakan energi, no…no…no !, hal tersebut terjadi karena proses kerja antar atom-atom dan molekul-molekul yang saling bertumbukan. Yang dimana hal tersebut akan menyebabkan terjadinya interaksi tarik-menarik yang kuat sehingga terjadilah pelepasan energi dari hasil interaksi tarik menarik tersebut.
Ingat! bukan suatu penciptaan melainkan hanya suatu pelepasan energi!
Jadi dalam suatu reaksi kimia hanya terjadi penyerapan atau pelepasan energi , pelepasan energi yang dihasilkan oleh suatu reaksi kimia bukan berarti reaksi kimia tersebut menciptakan energi, melainkan hanya suatu pelepasan energi.
Selain hukum kekekalan energi, terdapat 2 hukum lain yang mengatur tentang konteks dari ilmu termokimia ini, berikut ini kedua hukum tersebut.
1. Hukum Lavoiser Dan Laplace
Hukum Lavoiser dan Laplace menyatakan bahwa “perubahan energi saat terjadi reaksi bisa sama/berkebalikan dengan perubahan energi pada proses kebalikan “.
2. Hukum Hess
Hukum Hess menyatakan bahwa “kalor reaksi yang dihasilkan oleh suatu reaksi kimia adalah sama meskipun rute yang digunakan untuk mencapai reaksi kimia tersebut dilakukan tahap demi tahap atau secara langsung”.
Jenis Reaksi Termokimia
Berdasarkan pertukaran kalor antara sistem dengan lingkungan, reaksi termokimia dibedakan menjadi
dua yaitu reaksi eksoterm dan reaksi endoterm.
a. Reaksi Eksoterm
Dalam reaksi eksoterm entalpi zat yang bereaksi lebih besar daripada entalpi hasil reaksi. Oleh karena itu, terjadi perpindahan kalor dari sistem ke lingkungan. Dalam hal ini dapat diartikan bahwa kalor dilepaskan ke lingkungan. Aliran kalor tersebut digambarkan seperti gambardisamping.
Contoh reaksi eksoterm sebagai berikut:
- Fermentasi glukosa: C6H12O6(s) —> 2C2H5OH(ℓ) + 2CO2(g)Pada reaksi ini sistem mengalami kenaikan suhu sistem.
- Reaksi logam Na dengan air:2Na(s) + 2H2O(ℓ) -> 2NaOH(aq) + H2(g)Reaksi ini disertai ledakan dan kenaikan suhu sistem.
Reaksi eksoterm mengalami penurunan energi kimia sistem sehingga entalpi sistem berkurang. Oleh sebab itu ΔH reaksi eksoterm bertanda negatif (-).
b. Reaksi Endoterm
Dalam reaksi endoterm entalpi zat yang bereaksi lebih kecil daripada Kaior
entalpi zat hasil reaksi. Oleh karena itu, terjadi perpindahan kaior dari lingkungan ke sistem. Aliran kaior tersebut digambarkan seperti gambar di samping.
Contoh reaksi endoterm adalah pelarutan urea dalam air dengan reaksi:
CO(NH2)2(S) + H2O(ℓ) -> CO(NH2)2(aq) + H20 (ℓ) . Setelah urea larut suhu sistem mengalami penurunan.
Dalam reaksi endoterm kalor diserap oleh sistem sehingga energi kimia sistem meningkat dan entalpi sistem juga bertambah. Oleh karena itu, ΔH reaksi endoterm bertanda positif (+).
Perubahan Entalpi pada Reaksi Termokimia
Persamaan termokimia merupakan persamaan reaksi yang dilengkapi dengan perubahan entalpi (ΔH).
Selain itu, dalam persamaan termokimia juga mencantumkan jumlah mol zat yang dinyatakan dengan koefisien reaksi dan fase zat yang terlibat dalam reaksi, dengan satuan kilojoule (kJ). Sementara itu, satuan perubahan entalpi dalam molar yaitu kJ/mol atau kJ mol-1.
a. Reaksi Endoterm
Pada reaksi endoterm, entalpi produk lebih besar daripada entalpi reaktan sehingga entalpi sistem pada reaksi endoterm bertambah.
Oleh karena itu, ΔH > 0.
b. Reaksi Eksoterm
Pada reaksi eksoterm, entalpi produk lebih kecil daripada entalpi reaktan sehingga entalpi sistem pada reaksi eksoterm berkurang. Oleh karena itu, ΔH < 0.
Penulisan dan interpretasi persamaan termokimia diatur dalam pedoman berikut.
- Koefisien stoikiometri menunjukkan jumlah mol suatu materi.
- Jika letak reaktan dan produk pada persamaan dibalik, tanda ΔH-nya berubah menjadi kebalikannya.
Contoh:
Proses pembekuan air menjadi es membebaskan kalor sebesar 6,01 kj.
H2O(ℓ) -> H2O(s) ΔH = -6,01 kj/mol
Dengan demikian, untuk reaksi pelelehan es menjadi air memerlukan kalor sebesar 6,01 kj.
H2O(s) -> H20(ℓ) ΔH = +6,01 kj/mol - Jika koefisien persamaan digandakan, nilai*AH juga digandakan sesuai dengan perubahan faktor koefisien persamaan.
Contoh:
Jika koefisien persamaan pelelehan es digandakan dua kalinya, perubahan entalpinya juga dikalikan dua. Persamaan reaksi termokimianya menjadi:
2H2O(s) -> 2H20(ℓ) ΔH = +6,01 kj/mol - Wujud zat yang terlibat dalam reaksi harus ditulis dalam kurung dan italic untuk membantu menentukan perubahan entalpinya. Zat padat dinyatakan dengan (s), larutan dinyatakan dengan (aq), zat cair dinyatakan dengan (ℓ), dan zat gas dinyatakan dengan (g).
Baca juga ? Entalpi Termokimia – Pemanasan / Kalor Fisika – Soal dan Jawaban
Soal dan Jawaban Termokimia
1 Diketahui persamaan termokimia sebagai berikut :
2NO(g) + O2(g) → N2O4(g) ; ∆H = -A kJ
NO(g) + ½O2(g) → NO2(g) ; ∆H = -B kJ
Tentukan ∆H untuk reaksi 2NO2(g) → N2O4(g).
Pembahasan :
Untuk soal reaksi bersusun seperti ini, perhatikan persamaan yang ditanya. Pada bagian pereaksi (kiri) terdapat 2NO2 dan pada bagian hasil reaksi (kanan) terdapat N2O4.
Oleh karena itu, susunlah sedemikian rupa dua persamaan lain yang harga ∆H-nya diketahui agar di sebelah kiri terdapat 2NO2, dan di sebelah kanan terdapat N2O4.
Sekarang perhatikan persamaan no 2. Pada persamaan itu NO2 berada di sebelah kanan, maka reaksi harus dibalik karena kita menginginkan NO2 di sebelah kiri. Selanjutnya, karena kita menginginkan 2NO2, maka reaksi no 2 kita kali 2 begitu juga harga ∆H-nya.
Sedangkan persamaan no 1, N2O4 sudah berada di sebelah kanan jadi tidak perlu dibalik.
2NO(g) + O2(g) → N2O4(g) ; ∆H = -A kJ
2NO2(g) → 2NO(g) + O2(g) ; ∆H = +2B kJ —> berubah tanda & dikali 2.
——————————————————
2NO2(g) → N2O4(g) ; ∆H = (-A) + (+2B)= (-A + 2B) kJ
Untuk menyelesaikan reaksi bersusun, bila terdapat senyawa atau unsur yang sama dengan koefisien yang sama juga berada dalam posisi yang berlawanan (kiri-vs-kanan), maka akan habis.
2. Ke dalam kalorimeter dituangkan 50 g air dingin (25°C), kemudian ditambahkan 75g air panas (60°C) sehingga suhu campuran menjadi 35°C. Jika suhu kalorimeter naik sebesar 7°, tentukan kapasitas kalor kalorimeter? Diketahui kalor jenis air = 4,18 J g–1 °C–1.
Jawab:
Kalor yang dilepaskan air panas sama dengan kalor yang diserap air dingin dan kalorimeter.
QAir panas = QAir dingin + QKalorimeter
QAir panas = 75 g × 4,18 J g – 1 °C –1× (35 – 60)°C
= – 7.837,5 J
QAir dingin = 50 g × 4,18 J g – 1 °C –1 × (35 – 25)°C
= + 2.090 J
Qkalorimeter = Ck × Δ T
Oleh karena energi bersifat kekal maka
QAir panas + QAir dingin + QKalorimeter = 0
–7.837,5 J + 2.090 J + (Ck . 7°C) = 0
Ck = 7.837,5 2.090 J/7°C =821 J °C
Jadi, kapasitas kalor kalorimeter 821 J °C–1.
3. Diketahui persamaan termokimia berikut:
2NO(g) + O2(g) → N2O4(g); ΔH = a kJ
NO(g) + ½O2 → NO2(g) ; ΔH = b kJ
Besarnya ΔH untuk reaksi N2O4(g) → 2NO2(g) adalah…
A. (a + b) kJ
B. (a – 2b) kJ
C. (a + 2b) kJ
D. (-a + 2b) kJ
E. (2a + b) kJ
Pembahasan :
Langkah pengerjaan
1. Balik persamaan pertama, ΔH jadi negatif
2. Kali dua persamaan kedua, ΔH dikali 2
3. Jumlahkan ΔH
Tahapan pembentukan CS2 :
| N2O4(g) → 2NO(g) + O2(g) | ΔH = -a kJ |
| 2NO(g) + O2 → 2NO2(g) | ΔH = +2b kJ |
| N2O4(g) → 2NO2(g) | ΔH = (-a + 2b) kJ |
4. Kapur tohor (CaO) digunakan untuk melabur rumah agar tampak putih bersih. Sebelum kapur dipakai, terlebih dahulu dicampur dengan air dan terjadi reaksi yang disertai panas. Apakah reaksi ini eksoterm atau endoterm? Bagaimana perubahan entalpinya?
CaO(s) + H2O(l)→ Ca(OH)2 (s)
Oleh karena timbul panas, artinya reaksi tersebut melepaskan kalor atau reaksinya eksoterm, ini berarti kalor hasil reaksi lebih rendah dari pereaksi.
5. Pernyataan yang benar untuk reaksi
2CO(g) + O2(g) → 2CO2(g), H = x kJ
adalah…
A. Kalor pembentuk CO = 2x kJ/mol
B. Kalor penguraian CO = x kJ/mol
C. Kalor pembakaran CO = 2x kJ/mol
D. Kalor pembakaran CO = ½x kJ/mol
E. Kalor pembentukan CO2 = ½x kJ/mol
Pembahasan :
Reaksi di atas merupakan reaksi pembaaran karbonmonoksida dan menghasilkan karbondioksida. Pada reaksi tersebut dibakar dua mol karbondioksida, jadi untuk 1 mol karbondioksida kalor pembakarannya adalah ½x kJ/mol.
Reaksinya:
2CO(g) + O2(g) → 2CO2(g), H = x kJ
CO(g) + ½O2(g) → CO2(g), H = ½x kJ
6. Sebanyak 75 mL air dipanaskan dengan LPG. Jika tidak ada kalor yang terbuang, berapa kalor yang dilepaskan oleh LPG jika suhu air naik dari 25°C menjadi 90°C? Kalor jenis air, c = 4,18 J g –1°C–1, massa jenis air 1 g mL–1
• Hitung kalor yang diserap oleh air
• Hitung kalor yang dilepaskan dari hasil pembakaran gas LPG
ρ air = 1g mL–1 atau mair = ρ air × volume air
mair = 1 g mL–1 × 75 mL= 75 g
Kalor yang diserap air:
Qair = 75 g × 4,18 J g –1°C–1 × (90–25)°C
= 20,377 kJ
Kalor yang diserap air sama dengan kalor yang dilepaskan oleh pembakaran gas LPG.
Qair = QLPG atau QLPG = 20,377 kJ
Jadi, kalor yang dilepaskan oleh hasil pembakaran gas LPG sebesar 20,377 kJ.
7. Yang dapat disebut kalor pembentukan adalah kalor reaksi dari…
A. CO(g) + ½O2(g) → CO2(g)
B. 2S(s) + 3O2(g) → 2SO3(g)
C. Ag+(aq) + Cl–(aq) → AgCl(s)
D. Ag(s) + ½N2(g) + 3/2O2(g) → AgNO3(g)
E. SO2(g) + ½O2(g) → SO3(g)
Kalor pembentukan adalah kalor yang diperlukan atau dilepaskan pada pembentukan 1 mol suatu zat dari unsur-unsurnya secara langsung pada suhu dan tekanan normal.Ciri kalor pembentukan adalah pada pereaksi hanya ada unsur-unsur yang berdiri sendiri. Dari kelima reaksi di opsi jawaban, kalor reaksi yang dapat disebut kalor pembentukan adalah reaksi keempat.
Ag(s) + ½N2(g) + 3/2O2(g) → AgNO3(g)
Opsi jawaban kedua tidak disebut sebagai kalor pembentukan karena pada reaksi tersebut dihasilkan 2 mol SO3(g). Sedangkan opsi C menunjukkan ikatan ion.
8. Dalam kalorimeter yang telah dikalibrasi dan terbuka direaksikan 50g alkohol dan 3g logam natrium. Jika suhu awal campuran 30°C dan setelah reaksi suhunya 75°C, tentukan ΔHreaksi. Diketahui kalor jenis larutan 3,65 J g–1 °C–1, kapasitas kalor kalorimeter 150 J °C–1, dan suhu kalorimeter naik sebesar 10°C.
Qreaksi + Qlarutan + Qkalorimeter = 0
Qreaksi = –(Qlarutan + Qkalorimeter)
Qlarutan = (mlarutan) (clarutan) ( ΔT)
= (53g) (3,65 J g–1°C–1) (45°C)
= 8.705,25 J
Qkalorimeter = (Ck) ( Δ T)
= (150 J °C–1) (10°C) = 1.500 J
Qreaksi = –(8.705,25 + 1.500) J = –10.205,25 J
Jadi, reaksi alkohol dan logam natrium dilepaskan kalor sebesar 10.205 kJ. Oleh karena pada percobaan dilakukan pada tekanan tetap maka Qreaksi = Δ Hreaksi = –10.205 kJ.
9. Untuk membentuk 1 mol Ca(OH)2(aq) dari CaO(s) dan H2O(l) dilepaskan kalor sebanyak 258 kJ. Diagram tingkat energi yang sesuai dengan pernyataan tersebut adalah…
| (A) | E | Ca(OH)2(aq) |
| ↑ | ↓ ΔH = -258 kJ | |
| CaO(s) + H2O(l) |
| (B) | E | CaO(s) + H2O(l) |
| ↑ | ↓ ΔH = +258 kJ | |
| Ca(OH)2(aq) |
| (C) | E | CaO(s) + H2O(l) |
| ↑ | ↑ ΔH = +258 kJ | |
| Ca(OH)2(aq) |
| (D) | E | CaO(s) + H2O(l) |
| ↑ | ↓ ΔH = -258 kJ | |
| Ca(OH)2(aq) |
| (E) | E | Ca(OH)2(aq) |
| ↑ | ↑ ΔH = +258 kJ | |
| CaO(s) + H2O(l) |
Pembahasan :
Pada soal dijelaskan bahwa reaksi pembentukan 1 mol Ca(OH)2(aq) dari CaO(s) dan H2O(l) dilepaskan kalor sebanyak 258 kJ, artinya reaksi tersebut merupakan reaksi eksoterm (ΔH = -).
Karena perubahan entalpinya berharga negatif maka energi produk menjadi lebih rendah daripada energi reaktan. Dengan demikian, diagram tingkat energi yang tepat adalah:
| (D) | E | CaO(s) + H2O(l) |
| ↑ | ↓ ΔH = -258 kJ | |
| Ca(OH)2(aq) |
10. Larutan NaHCO3 (baking soda) bereaksi dengan asam klorida menghasilkan larutan natrium klorida, air, dan gas karbon dioksida. Reaksi menyerap kalor sebesar 11,8 kJ pada tekanan tetap untuk setiap mol baking soda. Tuliskan persamaan termokimia untuk reaksi tersebut.
NaHCO3(aq) + HCl(aq)→ NaCl(aq) + H2O( l) + CO2(g)
Oleh karena reaksi membutuhkan kalor maka entalpi reaksi dituliskan positif.
Persamaan termokimianya:
NaHCO3(aq) + HCl(aq)→ NaCl(aq) + H2O( l) + CO2(g) ΔH= +11,8 kJ
11. Diketahui reaksi:
2H2(g) + O2(g) → 2H2O(g) ; ΔH = -483,6 kJ
Pernyataan berikut yang benar adalah …
1. Perubahan entalpi pembentukan uap air 483,6 kJ
2. Pembentukan 1 mol uap air diperlukan 241,8 kJ
3. Pembakaran 1 mol gas hidrogen diperlukan 241,8 kJ
4. Pembentukan 2 mol uap air dilepaskan 483,6 kJ
Pada reaksi di atas dapat kita lihat dihasilkan 2 mol uap air (H2O). Jadi, reaksi di atas merupakan reaksi pembentukan 2 mol uap air.
Pada reaksi tersebut diketahui harga perubahan entalpinya bernilai negatif. Artinya, pada reaksi pembentukan 2 mol uap air, dilepaskan kalor sebesar 483,6 kJ.
Jika untuk membentuk 2 mol uap air dilepaskan kalor sebesar 483,6 kJ, maka pada pembentukan 1 mol uap air akan dilepasan kalor sebesar 241,8 kJ.
Jadi, opsi yang benar hanya opsi 4.
12. Jika diketahui persamaan termokimia seperti berikut :
2Fe(s) + 3/2O2(g) → Fe2O3(s) ; ∆H = -839,6 kJ
2Al(s) + 3/2O2(g) → Al2O3(s) ; ∆H = +1.680 kJ
Tentukan ∆H untuk reaksi 2Al(s) + Fe2O3(s) → 2Fe(s) + Al2O3(s).
Pembahasan :
Reaksi yang ditanya memiliki peraksi 2Al(s) + Fe2O3(s) dan hasil 2Fe(s) + Al2O3(s). Susun sedemikian rupa dua persamaan yang lain agar dihasilkan persamaan reaksi yang ditanya. berikut tahapannya :
- Persamaan 1 dibalik karena kita menginginkan Fe2O3 di sebelah kiri.Fe2O3(s) → 2Fe(s) + 3/2O2(g) ; ∆H = + 839,6 kJ —> berubah jadi +
- Persamaan 2 tidak berubah.
Selanjutnya susun dan jumlahkan reaksi seperti berikut :
Fe2O3(s) → 2Fe(s) + 3/2O2(g) ; ∆H = + 839,6 kJ
2Al(s) + 3/2O2(g) → Al2O3(s) ; ∆H = +1.680 kJ
2Al(s) + Fe2O3(s) → 2Fe(s) + Al2O3(s) ; ∆H = 839,6 + 1.680 = 2519.6 kJ
13. Bila 2,30 g dimetileter (Mr = 46) dibakar pada tekanan tetap, kalor yang dilepaskan adalah 82,5 kJ. Berdasarkan data ini, kalor pembakaran dimetileter adalah …
A. -413 kJ/mol
B. +825 kJ/mol
C. -825 kJ/mol
D. +1650 kJ/mol
E. -1650 kJ/mol
Jumlah mol dimetileter
| ⇒ n dimetileter = | gram |
| mr |
| ⇒ n dimetileter = | 2,30 |
| 46 |
⇒ n dimetileter = 0,05 mol
Karena untuk 1 mol dimetileter dilepaskan 82,5 kJ (Q = 82,5 kJ), maka untuk 0,05 mol dimetileter dilepaskan:
| ⇒ ΔH = | -82,5 |
| 0,05 |
⇒ ΔH = -1650 kJ/mol
Kalor pembakaran dimetileter:
⇒ H = -ΔH
⇒ H = 1650 kJ/mol
14. Sepotong es dimasukkan ke dalam botol plastik dan ditutup. Dalam jangka waktu tertentu es mencair, tetapi di dinding botol sebelah luar ada tetesan air. Dari mana tetesan air itu?
H2O(s) + kalor → H2O( l)
15. Diketahui persamaan termokimia sebagai berikut :
MO2 + CO → MO + CO2 ; ∆H = -20 kJ
M3O4 + CO → 3MO + CO2 ; ∆H = +6 kJ
3M2O3 + CO → 2M3O4 + CO2 ; ∆H = -12 kJ
Tentukan nilai ∆H reaksi 2MO2(g) + CO → M2O3 + CO2.
Pembahasan :
Reaksi yang ditanya memiliki peraksi 2MO2(g) + CO dan hasil M2O3 + CO2. Susun sedemikian rupa tiga persamaan yang lain agar dihasilkan persamaan reaksi yang ditanya. berikut tahapannya :
- Persamaan 1 dikali 2 karena kita menginginkan 2MO2 di sebelah kiri.2MO2 + 2CO → 2MO + 2CO2 ; ∆H = 2 (-20) = -40 kJ
- Persamaan 2 dibalik dan dikali 2/3 agar 2MO pada persamaan 1 habis.2MO + 2/3CO2 → 2/3M3O4 + 2/3CO ; ∆H = 2/3 (-6) = -4 kJ
- Persamaan 3 dibalik dan dikali 1/3 agar 2/3M3O4 pada persamaan 2 habis.2M3O4 + CO2 → 3M2O3 + CO ; ∆H = 1/3(+12) = +4 kJ
Selanjutnya susun dan jumlahkan reaksi seperti berikut :
2MO2 + 2CO → 2MO + 2CO2 ; ∆H = -40 kJ
2MO + 2/3CO2 → 2/3M3O4 + 2/3CO ; ∆H = -4 kJ
2/3M3O4 + 1/3CO2 → M2O3 + 1/3CO ; ∆H = +4 kJ
—————————————————— +
2MO2(g) + CO → M2O3 + CO2. ∆H = -40 -4 + 4 = -40 kJ
Keterangan :
2CO – (2/3CO + 1/3CO) = 2CO – CO = CO
2CO2 – (2/3CO2 + 1/3CO2 ) = 2CO2 – CO2 = CO2
16. Jika proses penguraian H2O ke dalam atom-atomnya memerlukan energi sebesar 220 kkal/mol, maka energi ikatan rata-rata O-H adalah…
A. +220 kJ
B.-220 kJ
C. +110 kJ
D. -110 kJ
E. +55 kJ
Pembahasan :
Energi ikatan rata-rata O-H
| ⇒ O-H = | +220 |
| 2 |
⇒ O-H = +110 kkal/mol
17. Sebanyak 2 mol H2(g) dan 1 mol O2(g) bereaksi membentuk air disertai pelepasan kalor sebesar 572 kJ.
2H2(g) + O2(g) → 2H2O( l) ΔH = –572 kJ
Tuliskan persamaan termokimia untuk pembentukan satu mol air. Tuliskan juga reaksi untuk kebalikannya.
Jawab:
Pembentukan satu mol air, berarti mengalikan persamaan termokimia dengan faktor
½ .H2(g) + ½ O2(g)→ H2O( l) ΔH = – 286 kJ
Untuk reaksi kebalikannya:
H2O( l) → H2(g) + ½ O2(g) ΔH = + 286 kJ
18. X dan Y adalah dua unsur gas yang dapat membentuk senyawa XY sebagai reaksi:
X2(g) + Y2(g) → 2XY(g); ΔH = a kJ
X2(g) + Y2(g) → 2XY(l); ΔH = b kJ
X2(g) + Y2(g) → 2XY(s); ΔH = c kJ
Kalor sublimasi senyawa XY (kJ/mol) pada penurunan temperatur adalah…
A. ½(c – 1)
B. c – a
C. ½(a – c)
D. a – c
E. a – b – c
Pembahasan :
Sublimasi adalah perubahan wujud zat dari padat langsung ke keadaan gas atau sebaliknya tanpa melalui keadaan cair. Jadi sublimasi senyawa XY adalah XY(s) → XY(g).
Langkah pengerjaan :
1. Persamaan pertama tetap
2. Balik persamaan ketiga, ΔH jadi negatif
3. Jumlahkan ΔH
Tahapan pembentukan CS2 :
| X2(g) + Y2(g) → 2XY(g) | ΔH = a kJ |
| 2XY(s) → X2(g) + Y2(g) | ΔH = -c kJ |
| 2XY(s) → 2XY(g) | ΔH = (a – c) kJ |
Pada reaksi di atas dihasilkan 2 mol XY(g). Jadi, untuk 1 mol XY(g) adalah:
XY(s) → XY(g); ΔH = ½(a – c) kJ
19. Berapa kalor yang diperlukan untuk menaikkan suhu 50 g air dari 25°C menjadi 60°C? Diketahui kalor jenis air, c = 4,18 J g–°C–1.
Kalor yang diperlukan untuk menaikkan suhu sebesar 35°C adalah sebanyak 35 kali kalor yang diperlukan untuk menaikkan suhu 1°C. Jadi, kalor yang diperlukan untuk menaikkan suhu 50 g air dari 25°C menjadi 60°C (ΔT = 35°C) adalah:
Q = m c ΔT
= 50 g × 4,18 J g–1°C–1 × 35°C
= 7,315 kJ
20. Diketahui:
CS2 + 3O2 → CO2 + 2SO2 ; ΔH = -1110 kJ
CO2 → C + O2 ; ΔH = +394kJ
SO2 → S + O2 ; ΔH = +297 kJ
Maka kalor pembentukan CS2 adalah…
B. -122 kJ
C. +419 kJ
D. -419 kJ
E. +906 kJPembahasan :
Langkah pengerjaan
1. Balik persamaan kedua, ΔH jadi negatif
2. Balik dan kali dua persamaan ketiga, ΔH jadi negatif dan dikali 2
3. Balik persamaan pertama, ΔH jadi positif
4. Jumlahkan ΔH
Tahapan pembentukan CS2 :
| C + O2 → CO2 | ΔH = -394 kJ |
| 2S + 2O2 → 2SO2 | ΔH = -594 kJ |
| CO2 + 2SO2 → CS2 + 3O2 | ΔH = +1110 kJ |
| C + 2S → CS2 | ΔH = +122 kJ |
21. Diketahui persamaan termokimia sebagai berikut :
NH3 + air → larutan NH4OH ; ∆H = +a kal
HCl + air → larutan HCl ; ∆H = +b kal
larutan NH4OH + larutan HCl → larutan NH4Cl ; ∆H = +c kal
NH3 + HCl → NH4Cl ; ∆H = +d kal
NH4Cl + air → larutan NH4Cl ; ∆H = +e kal
Tentukan hubungan a, b, c, d, dan e menurut Hukum Hess.
Pembahasan :
NH4Cl + air → larutan NH4Cl, merupakan persamaan terakhir, maka coba susun persamaan lainnya agar diperoleh persamaan permbentukan larutan NH4Cl.
- Persamaan 1 tetap
- Persamaan 2 tetap
- Persamaan 3 tetap
- Persamaan 4 dibalik karena kita menginginkan NH4Cl di sebelah kiri.NH4Cl → NH3 + HCl ; ∆H = -d kal —> berubah tanda jadi –
Selanjutnya susun dan jumlahkan persamaan-persamaan reaksi tersebut menjadi :
NH3 + air → larutan NH4OH ; ∆H = +a kal
HCl + air → larutan HCl ; ∆H = +b kal
larutan NH4OH + larutan HCl → larutan NH4Cl ; ∆H = +c kal
NH4Cl → NH3 + HCl ; ∆H = -d kal
————————————————————————— +
NH4Cl + air → larutan NH4Cl ; ∆H = +e kal
Jadi hubungannya adalah : e = a + b + c – d .
22. Pembakaran CS2(I) terjadi menuruut persamaan reaksi berikut . CS2(I) + 3O2(g) → CO2(g) + 2SO2 (g). Bila entalpi pembentukan standar Hr CS2 berturut turut adalah -115,3kJ/mol , dan -393,5kJ/mol , dan -296,8 kJ/mol , maka entalpi pembakaran 7,6 g CS2 (I) ( Mr = 76 )pada keadaan standar adalah …
a. +87,18 kJ
b. -87,18 kJ
c. +80,56 kJ
d. -80,56 kJ
e. +57,50 kJ
Jawaban :
ΔHf CS2 = _ 115,3 kj/mol
ΔHf CO2 = _ 393,5 kj/mol
ΔHf SO2 = _ 296,8 kj/mol
CS2 + 3O2 →CO2 + 2SO2
ΔHc = f produk _ f reaktan c
= _ 393,5 + 2 . (_ 296,8)) _( _115,3)
= _ 987,1 + 115,3 = _ 871,8 kj/mol
Mol CS2 = = 0,1 mol
ΔHc =0,1 mol x _ 871,8 kj/mol
= _ 87,18 kj/mol
23. Diketahui reaksi termokimia
C₂H₄ + 3O₂ → 2CO₂ + 2H₂O = a KJ
C₄H₈ + 6O₂ → 4CO₂ + 6H₂O = b KJ
Perubahan entalpi untuk reaksi 1 mol etena menjadi butena adalah:
a. (2a-b) KJ
b. ½ a (2a-b) KJ
c. –(2a-b ) KJ
d. -1/2 (2a – b) KJ
e. 2(2a-b) KJ
Jawaban : C
Reaksi I tetap maka = a Kj
Reaksi II dibalik dan dibagi 2 maka = ½ b kj
Sehingga diperoleh = ½ (2a-b) kj
Bacaan Lainnya
- Entalpi Termokimia- Pemanasan / Kalor Fisika – Soal dan Jawaban
- Gas Ideal – Tetapan Gas – Konstanta Gas Ideal – Soal dan Jawaban
- Rumus Fisika: Alat optik: Lup, Mikroskop, Teropong Bintang, Energi, Frekuensi, Gaya, Gerak, Getaran, Kalor, Massa jenis, Medan magnet, Mekanika fluida, Momen Inersia, Panjang gelombang, Pemuaian, Percepatan (akselerasi), Radioaktif, Rangkaian listrik, Relativitas, Tekanan, Usaha Termodinamika, Vektor
- Rumus Kimia Konsep Mol Dan Empiris Beserta Contoh Soal Dan Jawaban
- Sebagian cabang biologi: Biofisika
- Contoh Soal SBMPTN Beserta Jawabannya
- Tabel Periodik Lengkap Dengan Daftar Unsur Kimia Berdasarkan Nama, Warna Dan Jenis
- Pemahaman Kanker: Mengenal Dasar-Dasar, Contoh Kanker, Bentuk, Klasifikasi, Sel dan Pemahaman Penyakit Kanker Lebih Jelas
- Apakah Produk Pembalut Wanita Aman?
- Penyakit Difteri Penularan, Penyebab, Gejala, Perawatan dan Pencegahan
- Penyakit Kusta Penularan, Penyebab, Gejala, Perawatan dan Pencegahan
- Sakit Punggung: Penyebab, gejala, pencegahan dan perawatan
- Penyebab Dan Cara Mengatasi Iritasi Atau Lecet Akibat Pembalut Wanita
- Sistem Reproduksi Manusia, Hewan dan Tumbuhan
- Cara Mengenal Karakter Orang Dari 5 Pertanyaan Berikut Ini
- Kepalan Tangan Menandakan Karakter Anda & Kepalan nomer berapa yang Anda miliki?

Unduh / Download Aplikasi HP Pinter Pandai
Respons “Ooo begitu ya…” akan lebih sering terdengar jika Anda mengunduh aplikasi kita!
Siapa bilang mau pintar harus bayar? Aplikasi Ilmu pengetahuan dan informasi yang membuat Anda menjadi lebih smart!
Pinter Pandai “Bersama-Sama Berbagi Ilmu”
Quiz | Matematika | IPA | Geografi & Sejarah | Info Unik | Lainnya