Entropi, Rumus, dan Contoh Soal Serta Jawabannya
Entropi adalah suatu ukuran derajat ketidakteraturan suatu sistem termodinamika.
Entropi merupakan sebuah konsep dalam ilmu kimia dan fisika yang juga termasuk ke dalam ilmu termodinamika kimia ataupun dalam kimia fisika. Konsep entropi ini penting untuk menjelaskan terjadinya perubahan dalam suatu sistem termodinamika.
Contoh
- Jika kita melihat peristiwa di kehidupan seperti proses ketika es mencair dari bentuk padat menjadi bentuk cair. Dalam peristiwa tersebut terjadi perubahan pada sistem yaitu dari zat padat yang memiliki keteraturan tinggi menjadi zat cair dengan keteraturan yang rendah. Zat cair pun dapat berubah menjadi zat gas dengan keteraturan yang lebih rendah lagi. Tingkat keteraturan dan perubahan tersebut akan dipelajari dengan menggunakan ukuran entropi.
- Contoh lain yang mudah dibayangkan yaitu misalnya ketika kita mencampurkan air dengan massa yang sama namun memiliki suhu yang berbeda. Katakanlah kita mencampurkan air dengan suhu 20 dan 40. Hasilnya adalah akan didapatkan campuran air dengan suhu antara kedua suhu awal tersebut yaitu sekitar 30.
- Dalam kasus tersebut, entropi meningkat dengan alasan yaitu terjadi perpindahan panas dari air bersuhu tinggi ke air bersuhu rendah sehingga pencampuran tersebut akan mengurangi entropi air panas, namun meningkatkan entropi air dingin dengan jumlah yang lebih besar dan menghasilkan peningkatan entropi keseluruhan.
- Secara pasti kita tidak bisa menghitung berapa nilai entropi suatu sistem, namun kita hanya bisa menghitung besar perubahan entropi dalam suatu sistem yang mengalami perubahan. Perubahan entropi tersebut dikenal dengan S dimana semakin besar nilai tersebut maka perubahan ketidakteraturan dari suatu sistem juga semakin besar.
Bunyi Hukum Termodinamika 2
(Arah reaksi sistem dan batasan)
Hukum kedua ini membatasi perubahan energi mana yang bisa terjadi dan yang tidak. Pembatasan ini dinyatakan dengan berbagi cara, yaitu:
“Hukum II termodinamika dalam menyatakan aliran kalor. Kalor mengalir secara spontan dari benda bersuhu tinggi ke benda bersuhu rendah dan tidak mengalir secara spontan dalam arah kebalikannya”
Hukum II termodinamika dalam pernyataan tentang mesin kalor
Tidak mungkin membuat suatu mesin kalor yang bekerja dalam suatu siklus yang semata-mata menyerap kalor dari sebuah reservoir dan mengubah seluruhnya menjadi usaha luar.
Hukum II termodinamika dalam pernyataan entropi (besaran termodinamika yang menyertai suatu perubahan setiap keadaan dari awal sampai akhir sistem dan menyatakan ketidakteraturan suatu sistem)
Total entropi semesta tidak berubah ketika proses reversibel terjadi dan bertambah ketia proses irreversible terjadi.
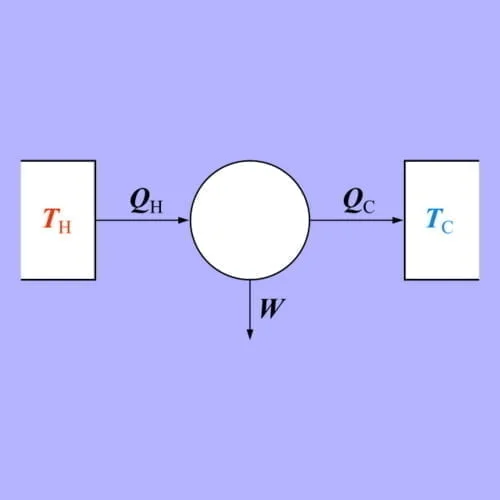
Entropi dan Hukum Kedua Termodinamika
Entropi sangat berkaitan dengan hukum termodinamika terutama untuk hukum kedua termodinamika. Hukum ini menyatakan bahwa total entropi dari suatu sistem tertutup tidak dapat berkurang. Namun dalam suatu sistem, entropi dari satu sistem dapat berkurang dengan meningkatnya entropi dari sistem lain.
Entropi adalah bagian dari sistem termodinamika yang dapat mengalami perubahan, namun total perubahannya yaitu nol. Selain itu, sistem tersebut juga tidak mempengaruhi entropi di lingkungannya karena perpindahan panas tidak terjadi dalam hal tersebut. Dengan demikian, proses reversibel tidak dapat mengubah total entropi sistem maupun entropi lingkungan.
Entropi sangat berbeda dengan energi dimana pada dasarnya entropi tidak bersifat konservatif namun dapat meningkat dalam prosesnya. Selain itu, proses yang terjadi juga reversibel (dapat balik).
Rumus Entropi dan Cara Menghitungnya
Ada beberapa cara atau persamaan untuk menghitung entropi dan perubahan entropi dalam suatu sistem termodinamika. Berikut ini adalah beberapa cara untuk menghitung entropi.
Entropi dari Proses Reversibel
Untuk suatu proses yang dapat balik atau disebut dengan reversibel, kita dapat mengasumsikan besaran entropi dari sistem tersebut. Dengan probabilitas yang sama, entropi sama dengan konstanta Boltzmann dikalikan dengan logaritma natural dari jumlah kemungkinan state yang terbentuk.
S = kB x ln W
Dimana konstanta Boltzman (kB) adalah 1.38065 × 10−23 J / K.
Entropi dari Proses Isotermal
Cara lain yang dapat dilakukan adalah dengan menghitung perubahan entropi (S) menggunakan perubahan panas yang terjadi (Q) dan juga adanya temperatur absolut (T).
ΔS = ΔQ / T
Berdasarkan persamaan tersebut, masuk akal jika entropi meningkat untuk perubahan temperatur dari panas ke dingin.
Entropi dan Energi Dalam
Dalam kimia fisik dan termodinamika, salah satu persamaan yang paing berguna dan berkaitan dengan entropi adalah energi dalam (U) yang menyertai suatu sistem termodinamika.
dU = T dS – p dV
Dalam hal ini, perubahan energi dalam (dU) sama dengan suhu absolut dikalikan dengan perubahan entropi yang dikurangi dengan tekanan eksternal (p) dan juga perubahan volume (V).
Contoh Soal Entropi
Adapun untuk mengulas lebih dalam berikut ini adalah contoh dan jawaban dalam soal entropi, antara lain;
- Diketahui sebanyak 1 mol air (H2O) memiliki suhu 100 dengan kalor 40,7 J/mol. Hitunglah nilai perubahan entropi untuk proses penguapan air tersebut.
Jawab :
Suhu 100 diubah dalam bentuk kelvin menjadi 373 K
ΔS = Q / T
ΔS = 40,07 / 373K
ΔS = 109,1 J / K mol
- Sebanyak 5 gram gas oksigen mengalami ekspansi dengan suhu 25 pada volume 1 L hingga 2 L. Dari data tersebut, hitunglah perubahan entropi yang terjadi pada proses tersebut.
Jawab :
W = – n R T ln V2/V1
W = – 5/32 x 8,314 x 298 x ln 2/1
W = -268 J dalam hal ini -W dianggap sama dengan Q
Perubahan entropi :
ΔS = Q / T
ΔS = -W/T
ΔS = -(-268)/298
ΔS = 0.9 J/K
- Suatu gas argon dengan tekanan 1 atm pada suhu ruang memiliki volume awal 500 cm3, pada pendinginan hingga suhu -25 volumenya berubah menjadi 50 cm3. Berdasarkan data tersebut, tentukan nilai perubahan entropi dari gas argon tersebut.
Jawab :
Volume 500 cm3 = 0,5 L
Suhu ruang = 25
Pertama yaitu mencari jumlah mol gas argon dalam kondisi awal tersebut.
P x V = n x R x T
1 atm x 0,5 L = n x 0,082 x 10-2 L atm / mol K x 290 K
n = 0,02 mol
Setelah diketahui jumlah mol maka dapat ditentukan perubahan entropinya.
Berdasarkan perubahan Volume
ΔS = n x R X ln V2/V1
ΔS = 0,02 x 8,314 x ln (0,05/0,5)
ΔS = – 0,39 J/K
Berdasarkan perubahan suhu
ΔS = n x Cv x ln (T2/T1)
ΔS = 0,02 x 12,48 x ln (248/298)
ΔS = -0,047 J/K
Maka nilai perubahan entropi total adalah
ΔS = -0,39 + (-0,047)
ΔS = -0,437 J/K
Bacaan Lainnya
- Entalpi Termokimia – Pemanasan / Kalor Fisika – Soal dan Jawaban
- Termokimia – Rumus, Penjelasan Beserta Contoh Soal dan Jawaban
- Tabel Periodik Lengkap Dengan Daftar Unsur Kimia Berdasarkan Nama, Warna dan Jenis
- Unsur, Senyawa dan Campuran Kimia – Beserta Penjelasan & Rumus
- Rumus Fisika: Alat optik: Lup, Mikroskop, Teropong Bintang, Energi, Frekuensi, Gaya, Gerak, Getaran, Kalor, Massa jenis, Medan magnet, Mekanika fluida, Momen Inersia, Panjang gelombang, Pemuaian, Percepatan (akselerasi), Radioaktif, Rangkaian listrik, Relativitas, Tekanan, Usaha Termodinamika, Vektor
- Bagaimana Albert Einstein mendapatkan rumus E=mc² ?
- Cara Mengemudi Aman Pada Saat Mudik atau Liburan Panjang
- Jenis Virus Komputer – Cara Gratis Mengatasi Dengan Windows Defender
- Cara Menghentikan Penindasan Bullying
- Cara menjaga keluarga Anda aman dari teroris – Ahli anti-teror menerbitkan panduan praktis
- Apakah Anda Memerlukan Asuransi Jiwa? – Cara Memilih Asuransi Jiwa Untuk Pembeli Yang Pintar
- 10 Cara Memotivasi Anak Untuk Belajar Agar Menjadi Pintar
- Daftar Jenis Kanker: Pemahaman Kanker, Mengenal Dasar-Dasar, Contoh Kanker, Bentuk, Klasifikasi, Sel dan Pemahaman Penyakit Kanker Lebih Jelas
- Penyebab Dan Cara Mengatasi Iritasi Atau Lecet Akibat Pembalut Wanita
- Sistem Reproduksi Manusia, Hewan dan Tumbuhan
- Cara Mengenal Karakter Orang Dari 5 Pertanyaan Berikut Ini
- Kepalan Tangan Menandakan Karakter Anda & Kepalan nomer berapa yang Anda miliki?
Unduh / Download Aplikasi HP Pinter Pandai
Respons “Ooo begitu ya…” akan lebih sering terdengar jika Anda mengunduh aplikasi kita!
Siapa bilang mau pintar harus bayar? Aplikasi Ilmu pengetahuan dan informasi yang membuat Anda menjadi lebih smart!
Sumber bacaan: Libretexts
Pinter Pandai “Bersama-Sama Berbagi Ilmu”
Quiz | Matematika | IPA | Geografi & Sejarah | Info Unik | Lainnya | Business & Marketing