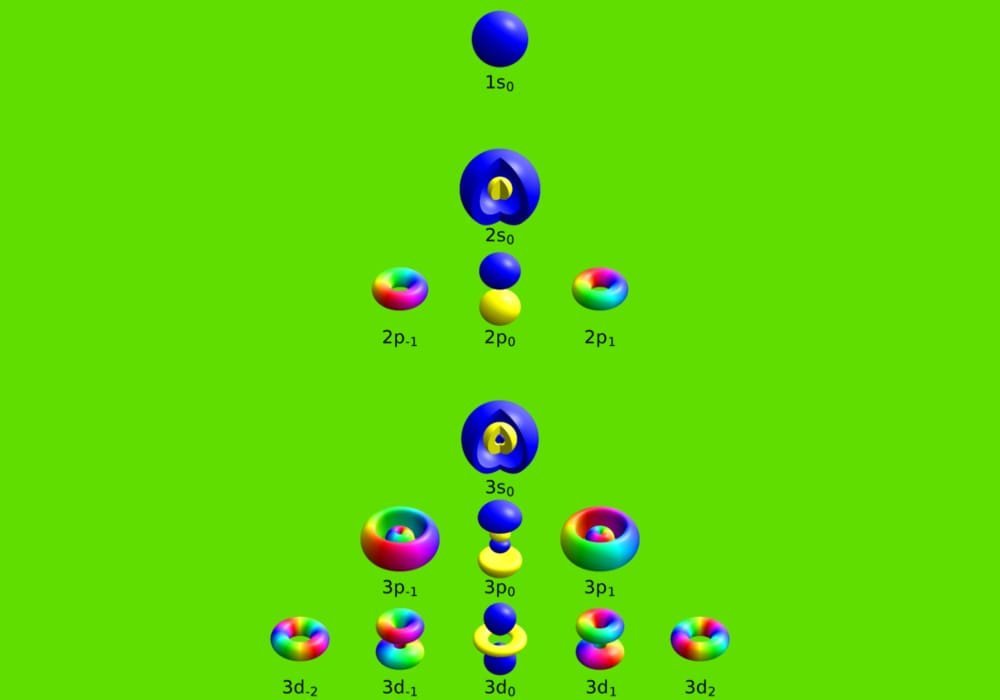
Penjelasan Bilangan Kuantum
Bilangan Kuantum adalah bilangan yang menyatakan kedudukan atau posisi elektron dalam atom yang diwakili oleh suatu nilai yang menjelaskan kuantitas kekal dalam sistem dinamis. Bilangan kuantum menggambarkan sifat elektron dalam orbital.
4 Bilangan kuantum
Dalam konfigurasi elektron model mekanika kuantum dikenal empat bilangan kuantum. Bilangan kuantum tersebut yang menjelaskan letak elektron – elektron suatu atom. Keempat bilangan kuantum tersebut adalah bilangan kuantum utama (n), azimuth (l), magnetik (m), dan spin (s).
Utama (n)
menyatakan tingkat energi utama dengan nilai n = 1, 2, 3, 4, 5, 6, dan 7.
- n = 1 menyatakakan kulit pertama (K)
- n = 2 menyatakakan kulit pertama (L)
- n = 3 menyatakakan kulit pertama (M)
- dan seterusnya
Azimuth (l)
menyatakan bentuk orbital tempat elektron berada pada subkulit. Nilai bilangan azimut dimulai dari l = 0, 1, 2, 3, dan seterusnya.
- Nilai l = 0 menyatakan subkulit s
- Nilai l = 1 menyatakan subkulit p
- Nilai l = 2 menyatakan subkulit d
- Nilai l = 3 menyatakan subkulit f
Magnetik (m)
Menyatakan letak elektron pada suatu orbital. Nilai bilangan kuantum m adalah …, – 1, 0, +1, …
- Untuk m = 0, subkulit s, m = 0 (terdapat 1 orbital)
- Untuk m = 1, subkulit p, m = – 1, 0, + 1 (terdapat 3 orbital)
- Untuk m = 2, subkulit d, m = –2, – 1, 0, + 1, +2 (terdapat 5 orbital)
- Untuk m = 3, subkulit f, m = –3, –2, – 1, 0, + 1, +2, + 3 (terdapat 7 orbital)
Spin (s)
Menyatakan arah perputaran elektron. Nilai bilangan kuantum s adalah – 1 dan + 1.
- s = +1 menyatakan arah putaran searah jarum jam dan digambarkan dengan tanda panah ke atas.
- s = – 1 menyatakan arah putaran berlawanan arah jarum jam digambarkan dengan tanda panah ke arah bawah.
Bilangan kuantum yang biasa dicari adalah bilangan kuantum dari elektron dengan tingkat energi paling tinggi atau elektron paling akhir. Contoh pada atom Oksigen (nomor atom 8) dengan konfigurasi elektron 1s2 2s2 2p4. Elektron dengan tingkat paling tinggi berada pada orbital 2p4. Nilai masing – masing bilangan kuantum dari 2p4 adalah n = 2, l = 1, m = – 1, dan s = – 1\2.
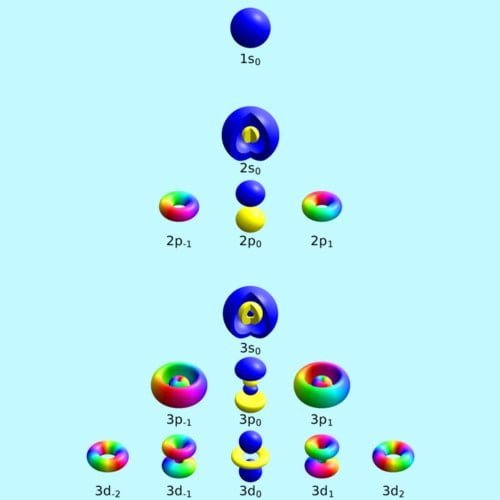
Penentuan konfigurasi elektron berdasarkan orbital yang meliputi asas Aufbau, Larangan Pauli, dan Kaidah Hund
Asas Aufbau
Pengisian elektron dimulai dari tingkat energi terendah ke tingkat energi yang lebih tinggi. Dengan urutan 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 7s 5f 6d 7p
Larangan Pauli
Menyatakan tidak ada dua elektron dalam satu orbital yang memiliki keempat bilangan kuantum yang sama.
Misalnya pada atom Helium (He) dengan nomor atom 2. Artinya, atom He memiliki jumlah elektron sebanyak 2 elektron. Letak elektron tersebut berada dalam orbital 1s. Tiga bilangan kuantumnya akan sama tetapi nilai tetapi nilai nilai s nya akan berbeda.
Kaidah Hund: keadaan atom paling stabil terjadi bila elektron-elektron tersebut tersebar ke semua orbital dengan spin yang sejajar (spin sama).
Nilai Angka Kuantum
Menurut prinsip pengecualian Pauli, tidak ada dua elektron dalam atom yang dapat memiliki set nomor kuantum yang sama. Setiap angka kuantum diwakili oleh nilai setengah-bilangan bulat atau bilangan bulat.
- Nomor kuantum utama adalah bilangan bulat yang merupakan jumlah kulit elektron. Nilainya 1 atau lebih tinggi (tidak pernah 0 atau negatif).
- Bilangan kuantum momentum sudut adalah bilangan bulat yang merupakan nilai dari orbital elektron (misalnya, s = 0, p = 1). ℓ lebih besar dari atau sama dengan nol dan kurang dari atau sama dengan n-1.
- Nomor kuantum magnetik adalah orientasi orbital dengan nilai integer mulai dari -ℓ hingga ℓ. Jadi, untuk orbital p, di mana ℓ = 1, m dapat memiliki nilai -1, 0, 1.
Angka kuantum putaran adalah nilai setengah bilangan bulat yang bisa -1/2 (disebut “spin down”) atau 1/2 (disebut “spin up”).
Contoh Bilangan Kuantum
Untuk elektron valensi luar atom karbon, elektron ditemukan dalam orbital 2p. Empat bilangan kuantum yang digunakan untuk menggambarkan elektron adalah n = 2, ℓ = 1, m = 1, 0, atau -1, dan s = 1/2 (elektron memiliki spin paralel).
Fungsi Bilangan Kuantum
Keempat bilangan tersebut digunakan untuk menunjukkan letak elektron terakhir (terluar) dari suatu atom. Dimulai dari letak kulit atom (utama), subkulit atom (azimut), letak orbital (magnetik) hingga perputaran elektronnya (spin).
Sehingga bilangan ini bersifat spesifik sesuai dengan azas larangan pauli. Selanjutnya kita gabungkan keempat bilangan kuantum tersebut untuk menentukan identitas suatu elektron. Agar dapat menentukan dengan tepat maka kita harus paham dengan konfigurasi elektron dan diagram orbital terlebih dahulu.
Contoh Soal Bilangan Kuantum
Sebuah elektron memiliki harga suatu bilangan kuantum utama (n) = 5. Tentukanlah masing-masing bilangan kuantum yang lainnya?
Jawaban:
Nilai n = 5
Nilai l = 0,1,2, dan 3
Nilai m = antara -1 dan +1
Untuk nilai l = 3 maka nilai m = – 3, -2, -1, 0, +1, +2, +3
Tentukanlah bilangan kuantum utama, azimut, dan magnetik yang mungkin bisa jadi dimiliki oleh suatu elektron yang menempati subtingkat energi 4d.
Pembahasan:
Subkulit 4d, berarti harga n = 4 dan l = 3. Jika l = 2 maka m = -3-2, -1, 0, +1, +2+3+
Demikian lah pembahasan kita mengenai masalah bilangan kuantum serta jenis-jenisnya, semoga bermanfaat.
Tentukan bilangan kuantum dari: 40Zr
1. Buat dulu konfigurasi elektronnya
40Zr = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d2
2. Keempat bilangan kuantum ditentukan dari konfigurasi elektron terakhir, yaitu 4d2
3. Karena Tingkat energi pada konfigurasi terakhir adalah 4, maka bil.kuantum utama (n) = 4
4. Karena konfigurasi berakhir di blok d, maka harga bilangan kuantum azimut (l) = 2 ( Jika berakhir di sub kulit s → l=0, p → l=1, d → l=2, f → l=3, dst..)
5. Karena berakhir pada blok d, maka jumlah orbital pada sub kulit d ada 5, yaitu dari –l, sampai dengan +l, termasuk 0, yaitu -2, -1, 0, +1, +2, dan karena jumlah elektron pada konfigurasi terakhir sebanyak 2, maka panah elektron diisi dari magnetik -2, dan -1, (yang lain kosong karena jumlah elektronnya hanya ada 2) maka harga bilangan kuantum magnetik (m) = – 1
6. karena arah panahnya ke atas, maka harga bilangan kuantum spin (s) = +½
KESIMPULAN : dari unsur 40Zr didapat n = 4, l = 2, m = –1, s = +½
PERIODE didapat dari tingkat energi tertinggi pada konfigurasi elektron, yaitu 5 pada 5s2, sehingga 40Zr akan berada pada Periode 5.
Sedangkan GOLONGAN, karena berakhir di blok d, maka pasti Golongan B, jumlah elektron pada 5s2 dan 4d2 kemudian di jumlah, yaitu 2 + 2 = 4 ditulis dengan angka romawi (IV), sehingga 40Zr akan berada pada Golongan IVB
CATATAN UNTUK MENENTUKAN GOLONGAN:
Jika berakhir di sub kulit s atau p, maka golongan A,
Jika berakhir di sub kulit d, maka golongan B
Jika berakhir di sub kulit f, maka golongan lantanida / aktinida (jika periode 6 maka lantanida, dan jika periode 7 aktinida)
KESIMPULAN :
40Zr → Periode 5, Golongan IVB.
Tentukan keempat bilangan kuantum elektron terakhir dari unsur dengan nomor atom 20 dan 30!
Jawaban:
20X = 1s2 2s2 2p6 3s2 3p6 4s2
elektron terakhir di : 4s2
n = 4
sub kulit : s —> maka l = 0
m = 0
s = -1/2 (panah ke bawah)
30Y = 1s2 2s2 2p6 3s2 3p6 4s2 3d10
elektron terakhir di : 3d10
n = 3
sub kulit : d —> maka l = 2
m = -2, -1, 0, +1, +2 —> jumlah elektron adalah 10 elektron berhenti pada m = +2
s = -1/2 (panah ke bawah)
Simak lebih lanjut di Brainly.co.id – https://brainly.co.id/tugas/17101130#readmore
Bilangan yang menyatakan pada tingkat energi mana suatu elektron terdapat adalah . . . . .
A. Bilangan kuantum
B. Bilangan kuantum utama
C. Bilangan kuantum azimuth
D. Bilangan kuantum magnetik
E. Bilangan kuantum spin
Pembahasan:
Bilangan kuantum ada 4 macam
Bilangan kuantum utama (n)
Nilai = 1, 2, 3, 4 …..dan seterusnya
Kegunaan = Menentukan tingkat energi atau kulit suatu elektron berada.
Jika:
n = 1 Kulit K
tingkat energi 1
n = 2 Kulit L
tingkat energi 2
n = 3 Kulit M
tingkat energi 3
Dan seterusnya.
Bilangan kuantum azimuth (l)
Nilai = 0, 1, 2 …….sampai (n-1)
Jika:
n = 1l = 0
n = 2 l = 0, 1
n = 3 l = 0, 1, 2
Dan seterusnya.
Kegunaan = Menyatakan di subkulit mana elektron berada
Jika:
l = 0 subkulit s
l = 1 subkulit p
l = 2 subkulit d
l = 3 subkulit f
Dan seterusnya.
Bilangan kuantum magnetik (m)
Nilai = – l, 0, +l
Kegunaan = Menyatakan di orbital mana elektron berada
Jika:
l = 0 m = 0 1
orbital
l = 1 m = -1, 0, +1
3 orbital
l = 2 m = -2, -2, 0, +1, +2
5 orbital
Dan seterusnya.
Bilangan Kuantum Spin(s)
Nilai = +1/2 dan -1/2
Kegunaan = Menyatakan arah perputaran elektron
Jika arah panahnya keatas = +1/2
Jika arah panahnya kebawah = -1/2
Jawaban : B
Bilangan kuantum azimuth (l) yang masih dimungkinkan untuk l = 4 adalah….
A. 1, 2, 3
B. 0, 1, 2, 3
C. 1, 2, 3, 4,
D. 0, 1, 2, 3, 4
E. Tidak bergantung pada harga n
Pembahasan :
Jika n = 4, maka :
Harga l = 0, …..(n-1) = 0, 1, 2, 3
Jawaban : B
Suatu unsur mempunyai bilangan kuantum elektron terakhir, n = 3, l = 2, m = 0, s=-1/2. Tentukan :
a.) konfigurasi elektron
b.) elektron valensi
c.) golongan
d.) periode
Jawaban:
Suatu unsur mempunyai bilangan kuantum elektron terakhir,
n = 3
l = 2, maka sub kulit : d
jadi, 3d
s = -1/2 (panah ke bawah)
m = -2, -1, 0, +1, +2 —-> berhenti di m = 0 (panah ke bawah) ketika jumlah elektron adalah 8elektron
jadi, 3d8
a.)konfigurasi elektron
X = 1s2 2s2 2p6 3s2 3p6 4s2 3d8
b.)elektron valensi
4s2 3d8 (pangkat dijumlahkan) = 2 + 8 = 10
c.)golongan
golongan = ns2 (n-1)d8 = VIII B
d.)periode = bilangan kuantum utama paling besar = 4
Jika suatu elektron mempunyai bilangan kuantum utama , n = 2, kemungkinan bilangan kuantumlainnya adalah…
B. l = 1, m = 2, s = -1/2
C. l = 2, m = -2, s = +1/2
D. l = 2, m = 2, s = -1/2
E. l = 2, m = 0, s = +1/2
Pembahasan :
Jika n = 2, maka
Harga l = 0, 1
Untuk l = 0 m = 0
Untuk l = 1 m = -1, 0, +1
Harga s yang mungkin tentunya hanya dua yaitu +1/2 dan -1/2
Ada beberapa kemungkinan jawaban untuk bilangan kuantum lainnya
n = 2, l = 0, m = 0 , s = +1/2 atau -1/2
n = 2, l =1, m = -1, 0, +1, s = +1/2 atau -1/2
Jawaban : A.
Bilangan kuantum magnetik (m) = -3 dimiliki oleh elktron dari atom yang memiliki kulit elektron minimal sebanyak…
A. 2
B. 3
C. 4
D. 5
D. 6
Pembahasan :
Jika memiliki m = -3, artinya nilai bilangan kuantum azimuth elektron dalam atom itu minimal adalah 3 karena nilai m itu bergantung pada harga l ( jika l = 3, maka harga m -nya = -3, -2, -1, 0, +1, +2, +3).
Untuk l = 3, maka minimal sebuah atom harus memiliki harga bilangan kuantum utama (n) adalah 4 karena nilai l itu dimulai dari 0, 1, ……sampai (n-1). Jadi jika n = 4, maka harga l = 0, 1, 2, 3.
Pada pembahasan soal no satu diatas sudah djelaskan bahwa bilangan kuantum utama menyatakan kulit atom. n = 4 artinya elektron berada pada tingkat energi ke empat atau kulit keempat (kulit N). Jadi agar suatu elektron memiliki nilai bilangan kuantum magnetik (m ) = – 3, maka atom itu harus memiliki setidaknya 4 buah kulit atom.
Jawaban : C.
Diantara harga keempat bilangan kuantum di bawah ini yang mungkin untuk pengisian elektron pada orbital 3p adalah…
A. n = 3, l = 2, m = -1, s = +1/2
B. n = 3, l = 1, m = -1, s = +1/2
C. n = 3, l = 2, m = +1, s = +1/2
D. n = 3, l = 2, m = 0, s = +1/2
E. n = 3, l = 2, m = +2, s = +1/2
Pembahasan :
Dari orbital 3p kita dapatkan :
Harga n = 3
Harga l = 1 (karena sub kulitnya adalah p)
Jika l = 1, maka harga m yang mungkin adalah -1, 0, +1
Harga s yang mungkin hanya dua yaitu +1/2 dan -1/2
Jadi kemungkina nilai keempat bilangan kuantum suatu elektron yang menempati subkulit/ orbital 3p adalah :
n = 3, l = 1, m = -1, 0, +1 dan s = +1/2 atau -1/2
Jawaban : B.
Sebuah elektron mempunyai harga pada sebuah bilangan kuantum utama (n) = 5. Maka tentukan masing-masing bilangan kuantum lainnya?
Jawaban:
Nilai n = 5
Nilai l = 0,1,2, dan 3
Nilai m = antara -1 dan +1
Untuk nilai l = 3
Jadi, nilai m = – 3, -2, -1, 0, +1, +2, +3
Tentukanlah sebuah bilangan kuantum utama, azimut, dan magnetik yang kemungkinan diperoleh pada suatu elektron yang menduduki subtingkat energi 4d.
Jawaban:
Subkulit 4d, adalah harga n = 4 dan l = 3. Jika l = 2 maka m = -3-2, -1, 0, +1, +2+3+
Elektron yang memiliki bilangan kuantum yang tidak diizinkan adalah…
A. n = 3, l = 0, m = 0, s = – 1/2
B. n = 3, l = 1, m = 1, s = + 1/2
C. n = 3, l = 2, m = -1, s = + 1/2
D. n = 3, l = 1, m = 2, s = – 1/2
E. n = 3, l = 1, m = 2, s = + 1/2
Pembahasan :
Kita lihat optionnya, biasanya soal soal seperti ini punya ciri ciri yang sama yaitu harga n-nya sama untuk semua option, sehingga kita tidak perlu mengecek satu per-satu. Kalau berbeda?? ya…berarti harus di cek satu persatu ….
Pada option soal diatas nilai n = 3, maka:
Harga l = 0, 1, 2
Untuk l = 0 m = 0
Untuk l = 1 m = -1, 0, +1
Untuk l = 2 m = -2, -1, 0 +1, +2
Harga s yang mungkin adalah +1/2 dan -1/2
Kemungkinan harga bilangan kuantum yang diizinkan :
n = 3, l = 0, m= 0, s = +1/2 atau -1/2
n = 3, l =1, m = -1, 0, +1, s = +1/2 atau -1/2
n = 3, l = 2, m = -2, -1, 0, +1, +2, s = +1/2 atau -1/2
Option A, B, C dan E benar menurut kemungkinan diatas, Option D dengan n = 3, l = 1, m = 2, s = – 1/2 adalah salah karena jika harga l = 1, tidak memungkinkan untuk m-nya memiliki nilai 2.
Jawaban : D.
Tuliskan semua bilangan kuantum untuk elektron yang terdapat pada tingkat energi L (n = 2)!
Jawaban:
n = 2
l = 0, 1
m = -1, 0, +1
s = + ½, – ½
Sehingga seluruh bilangan kuantumnya dapat disusun dalam tabel berikut:
| n | l | m | s |
| 2 | 0 | 0 | + ½ |
| 2 | 0 | 0 | – ½ |
| 2 | 1 | -1 | + ½ |
| 2 | 1 | -1 | – ½ |
| 2 | 1 | 0 | + ½ |
| 2 | 1 | 0 | – ½ |
| 2 | 1 | +1 | + ½ |
| 2 | 1 | +1 | – ½ |
Bacaan Lainnya
- Jari-Jari Atom – Jenis dan Nilai jari-jari atom
- Isotop Isobar Isoton – Penjelasan, Contoh Soal dan Jawaban
- Atom – Pengertian, Teori, Sifat, Struktur, Susunan
- Konfigurasi Elektron – Penjelasan Tabel konfigurasi elektron
- Reduktor dan Oksidator – Penjelasan, Contoh Soal dan Jawaban
- Bilangan Oksidasi Kimia (Biloks) – Aturan Penentuan Biloks, Tabel, Contoh Soal dan Jawaban
- Pembakaran Kimia – Persamaan Kimia – Sempurna & Tak Sempurna dan Contoh Soal beserta Jawabannya
- Tabel Periodik Lengkap Dengan Daftar Unsur Kimia Berdasarkan Nama, Warna dan Jenis
- Rumus Kimia Konsep Mol dan Empiris Beserta Contoh Soal & Jawaban
- Unsur, Senyawa dan Campuran Kimia – Beserta Penjelasan & Rumus
- Rumus Fisika: Alat optik: Lup, Mikroskop, Teropong Bintang, Energi, Frekuensi, Gaya, Gerak, Getaran, Kalor, Massa jenis, Medan magnet, Mekanika fluida, Momen Inersia, Panjang gelombang, Pemuaian, Percepatan (akselerasi), Radioaktif, Rangkaian listrik, Relativitas, Tekanan, Usaha Termodinamika, Vektor
- Bagaimana Albert Einstein mendapatkan rumus E=mc² ?
- Cara Mengemudi Aman Pada Saat Mudik atau Liburan Panjang
- Jenis Virus Komputer – Cara Gratis Mengatasi Dengan Windows Defender
- Cara Menghentikan Penindasan Bullying
- Cara menjaga keluarga Anda aman dari teroris – Ahli anti-teror menerbitkan panduan praktis
- Apakah Anda Memerlukan Asuransi Jiwa? – Cara Memilih Asuransi Jiwa Untuk Pembeli Yang Pintar
- 10 Cara Memotivasi Anak Untuk Belajar Agar Menjadi Pintar
- Di Indonesia, (HAN) Hari Anak Nasional tanggal 23 Juli
- Ibu Hamil Dan Bahaya Kafein – Sayur & Buah Yang Baik Pada Masa Kehamilan
- Daftar Jenis Kanker: Pemahaman Kanker, Mengenal Dasar-Dasar, Contoh Kanker, Bentuk, Klasifikasi, Sel dan Pemahaman Penyakit Kanker Lebih Jelas
- Penyebab Dan Cara Mengatasi Iritasi Atau Lecet Akibat Pembalut Wanita
- Sistem Reproduksi Manusia, Hewan dan Tumbuhan
- Cara Mengenal Karakter Orang Dari 5 Pertanyaan Berikut Ini
- Kepalan Tangan Menandakan Karakter Anda & Kepalan nomer berapa yang Anda miliki?
Unduh / Download Aplikasi HP Pinter Pandai
Respons “Ooo begitu ya…” akan lebih sering terdengar jika Anda mengunduh aplikasi kita!
Siapa bilang mau pintar harus bayar? Aplikasi Ilmu pengetahuan dan informasi yang membuat Anda menjadi lebih smart!
Sumber bacaan: Libretext, ThoughtCo, Toppr, Byjus, Electrical4u
Pinter Pandai “Bersama-Sama Berbagi Ilmu”
Quiz | Matematika | IPA | Geografi & Sejarah | Info Unik | Lainnya | Business & Marketing