Stoikiometri
Dalam ilmu kimia, stoikiometri adalah ilmu yang mempelajari dan menghitung hubungan kuantitatif dari reaktan dan produk dalam reaksi kimia (persamaan kimia).
Dasar hukum Stoikiometri
Stoikiometri didasarkan pada hukum-hukum dasar kimia, yaitu hukum kekekalan massa, hukum perbandingan tetap, dan hukum perbandingan berganda.
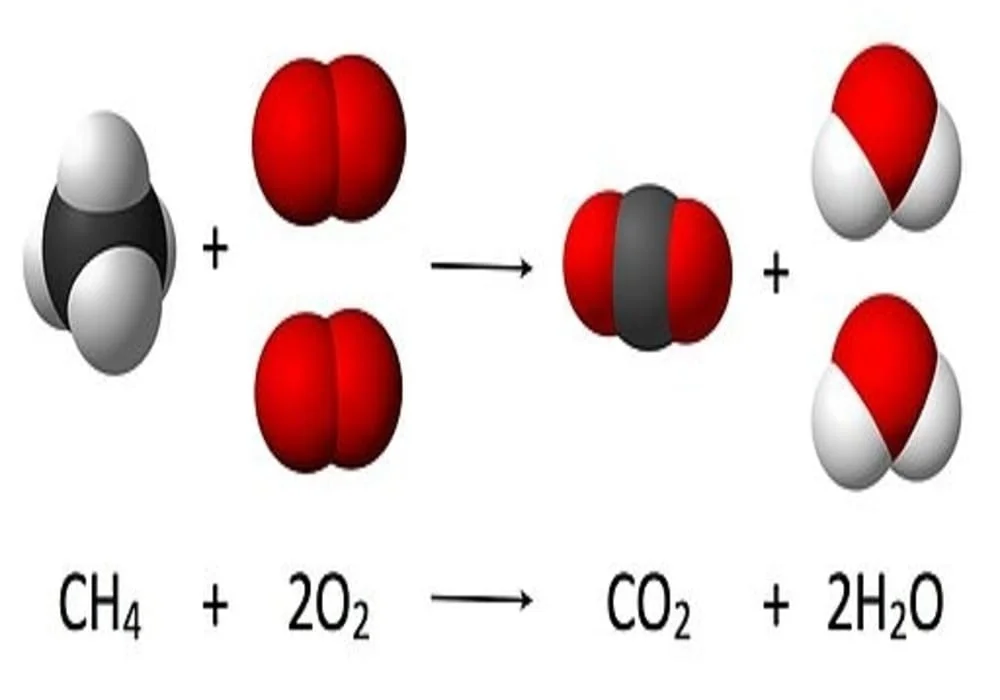
Stoikiometri diilustrasikan melalui gambar berikut, dengan persamaan reaksi setara:
- CH4 + 2 O2 → CO2 + 2 H2O.
Di sini, satu molekul metana bereaksi dengan dua molekul gas oksigen untuk menghasilkan satu molekul karbon dioksida dan dua molekul air. Persamaan kimia khusus ini adalah contoh pembakaran sempurna.
Stoikiometri mengukur hubungan kuantitatif ini, dan digunakan untuk menentukan jumlah produk dan reaktan yang diproduksi atau dibutuhkan dalam reaksi yang diberikan. Menggambarkan hubungan kuantitatif antara zat-zat ketika mereka berpartisipasi dalam reaksi kimia dikenal sebagai stoikiometri reaksi. Dalam contoh di atas, stoikiometri reaksi mengukur hubungan antara metana dan oksigen ketika mereka bereaksi membentuk karbon dioksida dan air.
Stoikiometri komposisi
Karena hubungan mol yang diketahui dengan massa atom, rasio yang diperoleh dengan stoikiometri dapat digunakan untuk menentukan jumlah massa dalam suatu reaksi yang dijelaskan oleh persamaan yang setimbang. Hal ini disebut sebagai stoikiometri komposisi.
Stoikiometri gas
Stoikiometri gas berkaitan dengan reaksi yang melibatkan gas, di mana gas berada pada suhu, tekanan, dan volume yang diketahui dan dapat dianggap gas ideal. Untuk gas, rasio volume idealnya sama dengan hukum gas ideal, tetapi rasio massa dari reaksi tunggal harus dihitung dari massa molekul dari reaktan dan produk. Dalam praktiknya, karena keberadaan isotop, massa molar digunakan sebagai gantinya ketika menghitung rasio massa.
Definisi
Suatu jumlah stoikiometris atau rasio stoikiometris dari suatu pereaksi adalah jumlah atau rasio optimal di mana, dengan asumsi bahwa reaksi berlangsung sampai selesai:
- Semua pereaksi dikonsumsi (habis bereaksi)
- Tidak ada kekurangan pereaksi
- Tidak ada kelebihan pereaksi (sisa)
Mengubah gram ke mol
Stoikiometri tidak hanya digunakan untuk menyeimbangkan persamaan kimia tetapi juga digunakan dalam konversi, misalnya, mengubah dari gram ke mol menggunakan massa molar sebagai faktor konversi, atau dari gram ke mililiter menggunakan kerapatan (densitas). Misalnya, untuk menentukan jumlah NaCl (natrium klorida) dalam 2 gram senyawa ini, maka dapat dikonversi dengan jalan:
Dalam contoh di atas, ketika dituliskan dalam bentuk pecahan, satuan gram membentuk identitas multiplikatif, yang setara dengan satu (g/g = 1), dengan jumlah yang dihasilkan dalam mol (unit yang dibutuhkan), seperti yang ditunjukkan pada persamaan berikut,
Proporsi molar
Stoikiometri sering digunakan untuk menyeimbangkan persamaan kimia (stoikiometri reaksi). Sebagai contoh, dua gas diatomik, hidrogen dan oksigen, dapat bergabung untuk membentuk cairan, air, dalam reaksi eksotermik, seperti dijelaskan oleh persamaan berikut ini:
- 2 H2 + O2 → 2 H2O
Stoikiometri reaksi menggambarkan perbandingan molekul hidrogen, oksigen, dan air 2: 1: 2 dalam persamaan di atas.
Rasio molar memungkinkan konversi antara satu mol zat dan mol lainnya. Misalnya dalam reaksi
- 2 CH3OH + 3 O2 → 2 CO2 + 4 H2O
jumlah air yang akan dihasilkan oleh pembakaran 0.27 mol CH3OH diperoleh dengan menggunakan rasio molar antara CH3OH dan H2O dari 2 menjadi 4.
Istilah stoikiometri juga sering digunakan untuk proporsi molar unsur-unsur dalam senyawa stoikiometris (stoikiometri komposisi). Misalnya, stoikiometri hidrogen dan oksigen dalam H2O adalah 2:1. Dalam senyawa stoikiometris, the molar proportions are whole numbers.
Rasio stoikiometris
Stoikiometri juga digunakan untuk menemukan jumlah yang tepat dari satu reaktan untuk “sepenuhnya” bereaksi dengan reaktan lain dalam reaksi kimia – yaitu, jumlah stoikiometris yang akan menghasilkan tidak ada reaktan sisa ketika reaksi berlangsung. Contoh ditunjukkan di bawah ini menggunakan reaksi termit,
- Fe2O3 + 2 Al → Al2O3 + 2 Fe
Persamaan ini menunjukkan bahwa 1 mol besi(III) oksida dan 2 mol aluminum akan menghasilkan 1 mol aluminium oksida dan 2 mol besi. Maka untuk tepat mereaksikan 85.0 g besi(III) oksida (0.532 mol), 28.7 g (1.06 mol) aluminium dibutuhkan.
Rasio reagen
Sejumlah stoikiometri (rasio reagen) atau zat yang ditambahkan ke sistem dalam rangka membuat reaksi kimia ialah jumlah atau rasio di mana, dengan asumsi bahwa hasil dari reaksi selesai dengan dasar sebagai berikut:
- Tidak ada sisa-sisa residu
- Semua reagen yang dikonsumsi
- Tidak ada defisit reagen
Reaksi hanya terjadi pada rasio stoikiometri
Stoikiometri bersandar pada hukum seperti hukum perbandingan tetap, hukum perbandingan ganda dan hukum kekekalan massa.
Hukum kekekalan massa = Menggunakan hukum-hukum fisika seperti hukum kekekalan massa, yang menyatakan massa reaktan sama dengan massa produk, Stoikiometri dipakai untuk mengumpulkan informasi tentang jumlah berbagai unsur yang digunakan di dalam reaksi kimia , dan apakah mereka mengambil bentuk gas, padat atau cairan.
Hukum perbandingan tetap = Ini menyatakan bahwasanya senyawa kimia (zat yang terdiri dari 2 atau lebih usnur) selalu berisi proporsi yang sama dari unsur (senyawa dengan satu jenis atom) dengan massa.
Tahap awal stoikiometri dan sejarah
Di awal kimia, aspek kuantitatif perubahan kimia, yakni stoikiometri reaksi kimia, tidak mendapat banyak perhatian. Bahkan saat perhatian telah diberikan, teknik dan alat percobaan tidak menghasilkan hasil yang benar.
Salah satu contoh melibatkan teori flogiston
Flogistonis mencoba menjelaskan fenomena pembakaran dengan istilah “zat dapat terbakar”. Menurut para flogitonis, pembakaran adalah pelepasan zat dapat terbakar (dari zat yang terbakar). Zat ini yang kemudian disebut ”flogiston”. Berdasarkan teori ini, mereka mendefinisikan pembakaran sebagai pelepasan flogiston dari zat terbakar. Perubahan massa kayu bila terbakar cocok dengan baik dengan teori ini. Namun, perubahan massa logam ketika dikalsinasi tidak cocok dengan teori ini. Walaupun demikian flogistonis menerima bahwa kedua proses tersebut pada dasarnya identik. Peningkatan massa logam terkalsinasi adalah merupakan fakta. Flogistonis berusaha menjelaskan anomali ini dengan menyatakan bahwa flogiston bermassa negatif.
Filsuf dari Flanders Jan Baptista van Helmont (1579-1644) melakukan percobaan “willow” yang terkenal. Ia menumbuhkan bibit willow setelah mengukur massa pot bunga dan tanahnya. Karena tidak ada perubahan massa pot bunga dan tanah saat benihnya tumbuh, ia menganggap bahwa massa yang didapatkan hanya karena air yang masuk ke bijih. Ia menyimpulkan bahwa “akar semua materi adalah air”. Berdasarkan pandangan saat ini, hipotesis dan percobaannya jauh dari sempurna, tetapi teorinya adalah contoh yang baik dari sikap aspek kimia kuantitatif yang sedang tumbuh. Helmont mengenali pentingnya stoikiometri, dan jelas mendahului zamannya.
Di akhir abad 18, kimiawan Jerman Jeremias Benjamin Richter (1762-1807) menemukan konsep ekuivalen (dalam istilah kimia modern ekuivalen kimia) dengan pengamatan teliti reaksi asam basa, yakni hubungan kuantitatif antara asam dan basa dalam reaksi penetralan. Ekuivalen Richter, atau yang sekarang disebut ekuivalen kimia, mengindikasikan sejumlah tertentu materi dalam reaksi. Satu ekuivalen dalam netralisasi berkaitan dengan hubungan antara sejumlah asam dan sejumlah basa untuk mentralkannya. Pengetahuan yang tepat tentang ekuivalen sangat penting untuk menghasilkan sabun dan serbuk mesiu yang baik. Jadi, pengetahuan seperti ini sangat penting secara praktis.
Istilah stoikiometri pertama kali digunakan oleh Richter pada tahun 1792 ketika volume pertama Stoichiometry or the Art of Measuring the Chemical Elements karangan Richter diterbitkan.
Pada saat yang sama Lavoisier menetapkan hukum kekekalan massa, dan memberikan dasar konsep ekuivalen dengan percobaannya yang akurat dan kreatif. Jadi, stoikiometri yang menangani aspek kuantitatif reaksi kimia menjadi metodologi dasar kimia. Semua hukum fundamental kimia, dari hukum kekekalan massa, hukum perbandingan tetap sampai hukum reaksi gas semua didasarkan stoikiometri. Hukum-hukum fundamental ini merupakan dasar teori atom, dan secara konsisten dijelaskan dengan teori atom. Namun, menarik untuk dicatat bahwa, konsep ekuivalen digunakan sebelum teori atom dikenalkan.
Jenis – Jenis Stoikiometri
1. Stoikiometri Reaksi
Stoikiometri yang sering dipakai dalam menyeimbangkan suatu persamaan kimia yang bisa ditemukan pada stoikiometri reaksi.
Hal tesebut menggambarkan pada suatu hubungan kuantitatif antara zat yang disebabkan karena telah berpartisipasi pada sebuah reaksi kimia.
2. Stoikiometri Komposisi
Stoikiometri komposisi ini dinyatakan sebagai kuantitatif (massa) yang merupakan suatu hubungan antara berbagai unsur-unsur pada reaksi senyawa.
Misalnya yaitu di dalam stoikiometri komposisi tersebut telah menggambarkan (massa) senyawa nitrogen dengan hidrogen yang berpartisipasi dan bisa menjadi amonia kompleks.
Yaitu 1 mol nitrogen dan 3 mol hidrogen pada setiap 2 mol amonia. Mol merupakan satuan yang bisa dipakai didalam kimia pada sejumlah zat.
3. Stoikiometri Gas
Jenis stoikiometri adalah yang bisa berhubungan dengan salah satu reaksi yang berhubungan dengan gas, yang mana dalam gas tersebut berada pada sebuah suhu, tekanan dan volume yang bisa dikenal juga bisa dianggap sebagai gas ideal.
Untuk gas, pada perbandingan volume idealnya tersebut itu berarti sama dengan hukum gas ideal. Tetapi pada sebuah rasio massa reaksi tunggal itu harus bisa dihitung dari massa molekul reaktan dan juga pada suatu produk yang mana massa molekul tersebut merupakan massa 1(satu) molekul zat.
Persamaan Hukum gas ideal adalah
PV = nRT
Keterangan:
- P = tekanan (atm)
- V = volume gas (liter)
- n = jumlah mol (mol)
- R = Tekanan gas = 0,082 L atm/mol K
- T = 0 °C = 273 K
Contoh Soal
1. Tentukan rumus empiris senyawa C6H12O6!
Pembahasan:
Rumus empiris diperoleh dengan menyederhanakan rumus molekul, seperti berikut ini.
C6H12O6 = (CH2O)6
Dengan demikian, rumus empiris dari C6H12O6 adalah CH2O.
2. Pada sebuah senyawa Propana yang terbakar dengan persamaan reaksi sebagai berikut yaitu: C3H8+O2⟶H2O+CO2
Jika 200 g propana yang terbakar, maka hitunglah berapa jumlah H2O yang seharusnya bisa terbentuk?
Penyelesaian dan jawaban:
Setarakan persamaan reaksinya!
Hitung mol C3H8!
mol=m/Mr -> mol= 200 g/ 44 g/mol ->mol= 4.54 mol
Hitung rasio H2O : C3H8 -> 4:1
Hitung mol H2O dengan perbandingan contohnya 1
mol H2O : 4 = mol C3H8 : 1
-> mol H2O : 4 = 4.54 mol : 1
-> mol H2O = 4.54 x 4= 18.18 mol
Konversi dari mol ke gram.
mol = m/Mr
m = mol x Mr
m = 18.18 mol x 18
m = 327.27 gram
3. Sebanyak 4,0 gram cuplikan yang mengandung senyawa hidrokarbon dibakar sempurna dengan gas oksigen. Jika presentase (%) massa karbon dalam cuplikan tersebut adalah 30%, maka massa karbon dioksida yang dihasilkan dalam proses pembakaran tersebut adalah…. (Ar C = 12, O = 16)
A. 3,3
B. 4,4
C. 5,4
D. 5,5
E. 6,0
Jawaban : B
Pembahasan :
%C = (mc / m cuplikan) x 100%
= 30% (mc/4) x 100%
120=100mc
mc=1,2gram
dengan menganggap massa sebelum = massa sesudah reaksi, maka massa C dalam cuplikan akan sama dengan massa C dalam CO2. Sehingga:
m unsur = ((Jumlah Unsur x Ar) / Mr)) x m senyawa
= 1,2 = ((1 x 12) / 44)) x m co2
52,8 = 12 mco2
mc02 = 4,4 gram
3. Reaksi pembentukan Titanium (IV) florida berlangsung sebagai berikut: 3 TiO2 (s) + BrF3 (l) → 3 TiF4 (s) + Br2 (l) + O2 (g)
Bila 3.2 gram cuplikan yang mengandung TiO2 menghasilkan 0.64 gram O2, maka persentase massa TiO2 dalam cuplikan tersebut adalah…. (Ar. Ti : 48, O : 16, F : 19, Br : 80)
A. 15 %
B. 25 %
C. 50 %
D. 70 %
E. 75 %
Jawaban : C
Pembahasan :
Reaksi di atas belum setara, maka disetarakan terlebih dahulu:
3 TiO2 (s) + 4 BrF3 (l) → 3 TiF4 (s) + 2 Br2 (l) + 3 O2 (g)
mol O2 = massa / Mr = 0,64 / 32 = 0,02 gram
Karena koefisien O2 dan koefisien TiO2 sama, maka mol TiO2 sama dengan mol O2 yaitu 0.02 mol
maka massa TiO2= mol x Mr =0,02 x 80 = 1,6 gram
% TiO2 dalam cuplikan = 1.6 / 3.2 x 100% = 50%
4. Perhatikan reaksi pembentukan amonia berikut: N2(g) + H2(g) ⇌ NH3(g)
Pada suhu dan tekanan yang sama, perbandingan volume gas-gas yang terlibat dalam reaksi tersebut secara berurutan adalah…
A. 1 : 1 : 1
B. 1 : 3 : 2
C. 2 : 2 : 3
D. 2 : 3 : 1
E. 2 : 1 : 3
Jawaban: B
Pembahasan:
Berdasarkan Hukum Gay Lussac, pada suhu dan tekanan yang sama, volume gas – gas yang terlibat dalam reaksi sebanding dengan koefisien dalam reaksi tersebut.
Reaksi pembentukan amonia setelah setara adalah sebagai berikut:
N2(g) + 3H2(g) ⇌ 2NH3(g)
Sehingga perbandingan volume gas N2, H2 dan NH3 berturut – turut adalah 1 : 3 : 2.
5. Senyawa oksida logam MxOy dihasilkan dari reaksi antara padatan logam M sebanyak 0,5 mol dengan 0,625 mol gas oksigen. Jika reaksi tersebut menghasilkan 0,25 mol oksida logam, maka rumus senyawa oksida tersebut adalah…
A. MO2
B. MO3
C. M2O
D. M2O3
E. M2O5
Jawaban: E
Pembahasan:
Reaksi pembentukan oksida logam MxOy adalah sebagai berikut:
M + O2 → MxOy
0,5 mol 0,625 mol 0,25 mol
Perbandingan mol ≈ perbandingan koefisien. Perbandingan mol spesi tersebut adalah 4 : 5 : 2. Sehingga perbandingan koefisien spesi tersebut juga 4 : 5 : 2.
4M + 5O2 → 2MxOy
Untuk menentukan nilai x dan y, dilihat dari jumlah atom – atom.
Jumlah atom kiri harus sama dengan jumlah atom kanan.
Atom M kiri = atom M kanan
4 = 2x
x = 2
Atom O kiri = atom O kanan
10 = 2y
Y = 5
Sehingga rumus oksida tersebut adalah M2O5.
6. Gas X sebanyak 0,20 gram menempati volume 440 mL. Jika 0,10 gram gas CO2 (P dan T sama) menempati volume 320 mL, maka gas X adalah SO2. (Ar C = 12, O = 16, S =32)
SEBAB
Gas X memiliki massa atom relatif sebesar 64.
Pembahasan:
Menurut hukum Avogadro, pada P dan T yang sama, gas-gas yang mempunyai volume sama akan memiliki jumlah molekul yang sama, sehingga:
nx/Vx = n co2/V co2 → (0,20 / Mr X / 440) = (0,20 / 44) / 320)
Mr X = 64
Gas SO2 memiliki Mr sebesar 64. Sehingga pernyataan pertama dan kedua adalah benar dan kedua pernyataan tersebut saling berkaitan.
Bacaan Lainnya
- Entalpi Termokimia – Pemanasan / Kalor Fisika – Soal dan Jawaban
- Termokimia – Rumus, Penjelasan Beserta Contoh Soal dan Jawaban
- Tabel Periodik Lengkap Dengan Daftar Unsur Kimia Berdasarkan Nama, Warna dan Jenis
- Unsur, Senyawa dan Campuran Kimia – Beserta Penjelasan & Rumus
- Rumus Fisika: Alat optik: Lup, Mikroskop, Teropong Bintang, Energi, Frekuensi, Gaya, Gerak, Getaran, Kalor, Massa jenis, Medan magnet, Mekanika fluida, Momen Inersia, Panjang gelombang, Pemuaian, Percepatan (akselerasi), Radioaktif, Rangkaian listrik, Relativitas, Tekanan, Usaha Termodinamika, Vektor
- Bagaimana Albert Einstein mendapatkan rumus E=mc² ?
- Cara Mengemudi Aman Pada Saat Mudik atau Liburan Panjang
- Jenis Virus Komputer – Cara Gratis Mengatasi Dengan Windows Defender
- Cara Menghentikan Penindasan Bullying
- Cara menjaga keluarga Anda aman dari teroris – Ahli anti-teror menerbitkan panduan praktis
- Apakah Anda Memerlukan Asuransi Jiwa? – Cara Memilih Asuransi Jiwa Untuk Pembeli Yang Pintar
- 10 Cara Memotivasi Anak Untuk Belajar Agar Menjadi Pintar
- Daftar Jenis Kanker: Pemahaman Kanker, Mengenal Dasar-Dasar, Contoh Kanker, Bentuk, Klasifikasi, Sel dan Pemahaman Penyakit Kanker Lebih Jelas
- Penyebab Dan Cara Mengatasi Iritasi Atau Lecet Akibat Pembalut Wanita
- Sistem Reproduksi Manusia, Hewan dan Tumbuhan
- Cara Mengenal Karakter Orang Dari 5 Pertanyaan Berikut Ini
- Kepalan Tangan Menandakan Karakter Anda & Kepalan nomer berapa yang Anda miliki?
Unduh / Download Aplikasi HP Pinter Pandai
Respons “Ooo begitu ya…” akan lebih sering terdengar jika Anda mengunduh aplikasi kita!
Siapa bilang mau pintar harus bayar? Aplikasi Ilmu pengetahuan dan informasi yang membuat Anda menjadi lebih smart!
Sumber bacaan: Libretexts