Bilangan Avogadro
Bilangan Avogadro adalah banyaknya “entitas” (biasanya atom atau molekul) dalam satu mol, yang merupakan jumlah atom karbon-12 dalam 12 gram (0,012 kilogram) karbon-12 dalam keadaan dasarnya.
Bilangan Avogadro (lambang: L, atau NA), juga dinamakan sebagai tetapan Avogadro atau konstanta Avogadro.
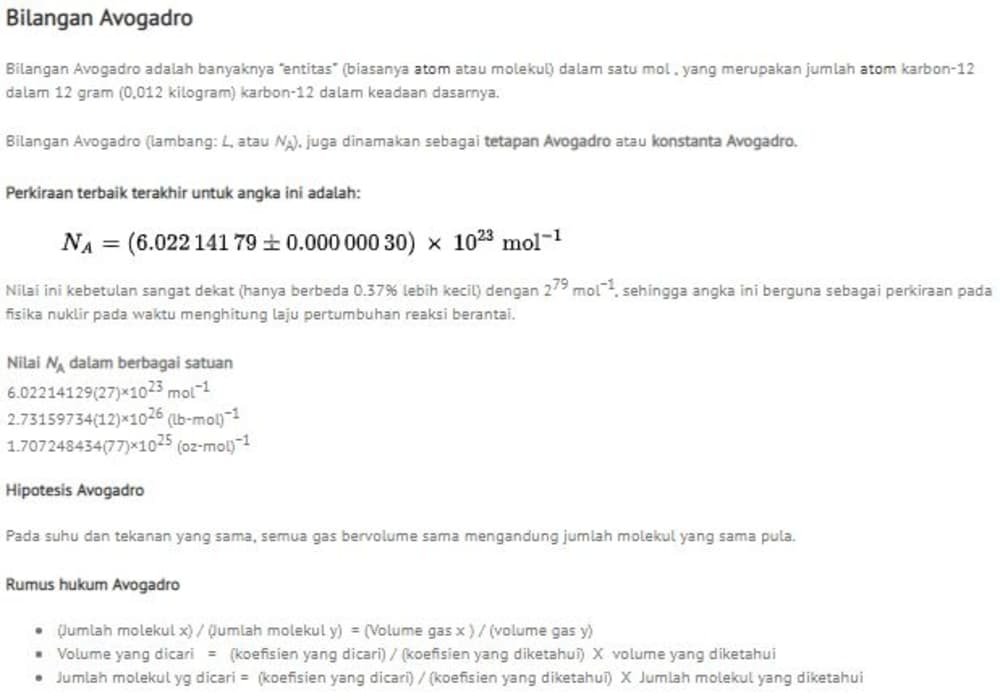
Perkiraan terbaik terakhir untuk angka ini adalah:
Nilai ini kebetulan sangat dekat (hanya berbeda 0.37% lebih kecil) dengan 279 mol−1, sehingga angka ini berguna sebagai perkiraan pada fisika nuklir pada waktu menghitung laju pertumbuhan reaksi berantai.
| Nilai NA dalam berbagai satuan |
|---|
| 6.02214129(27)×1023 mol−1 |
| 2.73159734(12)×1026 (lb-mol)−1 |
| 1.707248434(77)×1025 (oz-mol)−1 |
Hipotesis Avogadro
Pada suhu dan tekanan yang sama, semua gas bervolume sama mengandung jumlah molekul yang sama pula.
Rumus hukum Avogadro
- (Jumlah molekul x) / (Jumlah molekul y) = (Volume gas x ) / (volume gas y)
- Volume yang dicari = (koefisien yang dicari) / (koefisien yang diketahui) X volume yang diketahui
- Jumlah molekul yg dicari = (koefisien yang dicari) / (koefisien yang diketahui) X Jumlah molekul yang diketahui
Rumus-rumus Avogadro
Hukum Avoadro dapat dinyatakan melalui persamaan:
atau
dalam persamaan di atas:
- V adalah volume gas;
- n adalah jumlah zat dari gas tersebut (diukur dalam mol);
- k adalah konstanta kesebandingan.
Hukum ini menjelaskan bagaimana, dalam kondisi suhu dan tekanan yang sama, volume sebanding dari semua gas mengandung jumlah molekul yang sama.
Untuk membandingkan zat yang sama dalam dua kondisi yang berbeda, hukum ini dapat dinyatakan melalui persamaan:
Persamaan ini menunjukkan bahwa, ketika jumlah mol gas meningkat, volume gas juga meningkat secara proporsional.
Demikian pula, jika jumlah mol gas berkurang, maka volumenya juga berkurang. Sehingga, jumlah molekul atau atom dalam sejumlah volume spesifik gas ideal tidak bergantung pada ukuran atau massa molar dari gas tersebut.
Penurunan dari hukum gas ideal
Penurunan rumusan hukum Avogadro mengikuti langsung dari hukum gas ideal, yaitu
- ,
yang dalam persamaan tersebut R adalah konstanta gas, T adalah suhu dalam Kelvin, dan P adalah tekanan (dalam Pascal).
Untuk mendapat V/n, karenanya diperoleh
- .
Sebagai perbandingan didapat
yang bernilai konstan bagi suhu dan tekanan tetap.
Rumusan yang sebanding bagi hukum gas ideal dapat ditulis menggunakan konstanta Boltzmann kB, yaitu
- ,
yang dalam persamaan ini N adalah jumlah partikel dalam gas, dan perbandingan R dan kB sebanding dengan tetapan Avogadro.
Dalam bentuk ini, untuk V/N bernilai konstan, diperoleh
- .
Jika T dan P dilakukan pada suhu dan tekanan standar (STP), maka k‘=1/n0, di mana n0 adalah konstanta Loschmidt.
Volume molar
Dengan mengambil keadaan STP sebesar 101.325 kPa dan 273.15 K, maka volume dari satu mol gas dapat dihitung:
Untuk 100.00 kPa dan 273.15 K, volume molar dari suatu gas ideal adalah 22.712 dm3mol−1.
Sejarah Konstanta Avogadro
Konstanta Avogadro dinamakan menurut seorang ilmuwan Italia dari awal abad ke-19, Amedeo Avogadro, yang pada tahun 1811 pertama kalinya mengemukakan bahwa volume suatu gas (pada tekanan dan suhu tertentu) berbanding lurus dengan jumlah atom atau molekul tanpa tergantung dari jenis gas.
Fisikawan Prancis, Jean Perrin, pada tahun 1909 mengusulkan penamaan konstanta ini untuk menghormati Avogadro. Perrin mendapat penghargaan Nobel Prize in Physics tahun 1926, terutama karena karyanya dalam menentukan bilangan Avogadro dengan beberapa metode.
Nilai bilangan Avogadro ini pertama kali diperkirakan oleh Johann Josef Loschmidt, yang pada 1865 menghitung diameter rata-rata molekul di udara dengan metode yang sama dengan menghitung jumlah partikel di dalam volume gas tertentu dalam keadaan standar.
Densitas jumlah partikel dalam suatu gas ideal
Nilai ini, densitas jumlah partikel dalam suatu gas ideal, sekarang disebut Tetapan atau Konstanta Loschmidt untuk menghormatinya, dan terkait dengan bilangan Avogadro, NA, melalui persamaan:
di mana p0 adalah tekanan, R adalah konstanta gas dan T0 adalah suhu mutlak. Hubungan dengan Loschmidt adalah akar dari lambang L yang kadang digunakan untuk bilangan Avogadro constant, dan kepustakaan bahasa Jerman dapat merujuk kedua konstanta ini dengan nama yang sama, dibedakan hanya dari satuan ukurannya.
Peranan Bilangan Avogadro Secara Umum dalam Sains
Bilangan Avogadro merupakan faktor skala antara pengamatan makroskopik dan mikroskopik (skala atom) dari alam, yaitu mengkaitkan sejumlah konstanta fisika dengan sifat-sifat. Misalnya, konstanta ini memberikan hubungan antara konstanta gas R dan konstanta Boltzmann kB,
dan konstanta Faraday F dan muatan elementer e,
Bilangan Avogadro juga masuk ke dalam definisi satuan massa atom bersatu, u,
di mana Mu merupakan konstanta massa molar.
Pengukuran Bilangan Avogadro
Coulometry
Metode akurat paling awal untuk mengukur bilangan Avogadro didasarkan pada metode coulometry. Prinsipnya adalah pengukuran konstanta Faraday, F, yaitu muatan listrik yang dibawa oleh satu mol elektron, dan dibagi dengan muatan elementer, e, untuk mendapatkan bilangan Avogadro.
Eksperimen yang klasik dilakukan oleh Bower dan Davis pada NIST, dan berpatokan pada pelarutan logam perak dari anoda suatu sel elektrolisis, ketika dilewati oleh suatu aliran listrik konstan I selama waktu t yang diketahui.
Jika m adalah massa perak yang hilang dari anode dan Ar adalah berat atom perak, maka konstanta Faraday dapat dihitung melalui:
Ilmuwan-ilmuwan NIST merancang suatu metode untuk mengkompensasi perak yang hilang dari anode karena sebab mekanik, dan menjalankan sebuah analisis isotop perak yang digunakan untuk menentukan berat atomnya.
Nilai yang mereka dapatkan untuk konstanta Faraday konvensional adalah F90 = 96,485.39(13) C/mol, yang bersesuaian dengan nilai bilangan Avogadro 6.0221449(78)×1023 mol−1: kedua nilai ini mempunyai ketidakpastian standar relatif sebesar 1.3×10−6.
Pengukuran massa elektron
Committee on Data for Science and Technology (CODATA) menerbitkan nilai-nilai konstanta fisika untuk penggunaan internasional. Bilangan Avogadro ditentukan dari rasio massa molar suatu elektron Ar(e)Mu dengan massa diam elektron me:
Massa atom relatif dari elektron, Ar(e), merupakan kuantitas yang langsung terukur, dan konstanta massa molar, Mu, merupkana konstanta yang didefinisikan dalam SI.
Massa diam elektron
Namun, massa diam elektron dihitung dari konstanta-konstanta lain yang terukur:
Sebagaimana dapat dilihat pada tabel nilai-nila CODATA 2006 di bawah ini, faktor pembatas utama dalam ketepatan bilangan Avogadro adalah ketidakpastian dari nilai Konstanta Planck, karena konstanta lain yang terlibat semuanya diketahui lebih tepat nilainya.
| Konstanta | Simbol | Nilai CODATA 2006 | Ketidakpastian standar relatif | Koefisien korelasi dengan NA |
|---|---|---|---|---|
| Massa atom relatif suatu elektron | Ar(e) | 5.485 799 0943(23)×10–4 | 4.2×10–10 | 0.0082 |
| Konstanta massa molar | Mu | 0.001 kg/mol = 1 g/mol | defined | — |
| Konstanta Rydberg | R∞ | 10 973 731.568 527(73) m−1 | 6.6×10–12 | 0.0000 |
| Konstanta Planck | h | 6.626 068 96(33)×10–34 J s | 5.0×10–8 | −0.9996 |
| Kecepatan cahaya | c | 299 792 458 m/s | di | — |
| Konstanta struktur halus | α | 7.297 352 5376(50)×10–3 | 6.8×10–10 | 0.0269 |
| Bilangan Avogadro | NA | 6.022 141 79(30)×1023 mol−1 | 5.0×10–8 | 1 |
Soal dan Jawaban Bilangan Avogadro
1. Pada suhu dan tekanan tertentu, gas N2 direaksikan dengan gas H2 menjadi gas NH3. Jika gas H2 yang bereaksi sebanyak 7,5 × 1023 molekul, berapakah jumlah molekul NH3 yang terbentuk?
- Pada suhu dan tekanan yang sama, gas-gas yang volumenya sama akan mengandung jumlah molekul yang sama (menurut Avogadro)
- Koefisien reaksi menyatakan perbandingan volume gas-gas yang bereaksi (menurut Gay Lussac).
- Persamaan reaksi kimia dari reaksi N2 dan H2 dapat dituliskan sebagai berikut:
2. Sebanyak 35 L gas karbon dioksida mengandung 4,5 x 1023 molekul pada suhu dan tekanan yang sama, tentukan:
Jumlah molekul 7 L gas hidrogen
Volume gas amoniak yang mengandung 9 x 1023 molekul
Jawaban:
1. Jumlah molekul H2 = (volume H2) / (Volume CO2) X jumlah molekul CO2
= (7 L) / (35 L) X 4,5 x 1023 molekul
= 0,9 x 1023 molekul
= 9 x 1022 molekul
Jadi 7 L hidrogen mengandung 9 x 1022 molekul
2. Volume NH3 = (jumlah molekul NH3)/(jumlah molekul CO2) X volume CO2
= 9 x 1023 molekul / 4,5 x 1023 molekul X 35 L
= 70 L
Jadi 9 x 10 23 molekul gas amoniak memiliki vlume sebesar 70 L
3. Jika 5 liter gas hidrogen pada suhu dan tekanan yang sama jumlah molekulnya 3n, maka tentukan:
Volume gas CO2 yang mengandung 6n buah molekul CO2.
Jumlah molekul dari 15 liter gas oksigen
4. Pada pembakaran 5 liter (T, P) alkohol menurut reaksi:
C2H5OH(g) + O2(g) → CO2(g) + H2O(l)
Tentukan volume oksigen (T, P) dan volume gas karbon dioksida (T, P)!
5. Pada pembakaran sempurna 5 liter (T, P) gas CxHy diperlukan 15 liter (T, P) gas oksigen dan dihasilkan 10 liter (T, P) gas karbon dioksida sesuai persamaan reaksi berikut.
CxHy(g) + O2(g) → CO2(g) + H2O(l) (belum setara)
Tentukan rumus molekul CxHy tersebut!
5. Berapa volume 4 g gas metana (CH4) yang diukur pada keadaan sama dengan 3 g NO volumenya 5 L (Ar : H = 1, C = 12, N = 14, O = 16)?
6. Diketahui 0,5 liter gas hidrokarbon CxHy tepat bereaksi dengan 1,75 liter gas oksigen menghasilkan 1 liter gas karbon dioksida dan 1,5 liter uap air. Semuanya diukur pada suhu dan tekanan yang sama. Tentukan rumus kimia gas hidrokarbon tersebut!
7. Dalam satu wadah terdapat L partikel gas hidrogen. Jika L adalah bilangan Avogadro, volume wadah yang ditempati gas tersebut pada suhu dan tekanan standar adalah…
8. Tiga liter gas metana (CH4) dibakar sempurna menghasilkan gas CO2 dan H2O. Jika pengukuran dilakukan pada suhu dan tekanan yang sama, maka tentukan:
Persamaan reaksinya.
Volume gas oksigen yang diperlukan.
Volume gas CO2 yang dihasilkan.
Volume uap air yang dihasilkan.
Bacaan Lainnya
- Jari-Jari Atom – Jenis dan Nilai jari-jari atom
- Atom – Pengertian, Teori, Sifat, Struktur, Susunan
- Konfigurasi Elektron – Penjelasan Tabel konfigurasi elektron
- Reduktor dan Oksidator – Penjelasan, Contoh Soal dan Jawaban
- Bilangan Oksidasi Kimia (Biloks) – Aturan Penentuan Biloks, Tabel, Contoh Soal dan Jawaban
- Pembakaran Kimia – Persamaan Kimia – Sempurna & Tak Sempurna dan Contoh Soal beserta Jawabannya
- Tabel Periodik Lengkap Dengan Daftar Unsur Kimia Berdasarkan Nama, Warna dan Jenis
- Rumus Kimia Konsep Mol dan Empiris Beserta Contoh Soal & Jawaban
- Unsur, Senyawa dan Campuran Kimia – Beserta Penjelasan & Rumus
- Rumus Fisika: Alat optik: Lup, Mikroskop, Teropong Bintang, Energi, Frekuensi, Gaya, Gerak, Getaran, Kalor, Massa jenis, Medan magnet, Mekanika fluida, Momen Inersia, Panjang gelombang, Pemuaian, Percepatan (akselerasi), Radioaktif, Rangkaian listrik, Relativitas, Tekanan, Usaha Termodinamika, Vektor
- Bagaimana Albert Einstein mendapatkan rumus E=mc² ?
- Cara Mengemudi Aman Pada Saat Mudik atau Liburan Panjang
- Cara Menghentikan Penindasan Bullying
- Cara menjaga keluarga Anda aman dari teroris – Ahli anti-teror menerbitkan panduan praktis
- Apakah Anda Memerlukan Asuransi Jiwa? – Cara Memilih Asuransi Jiwa Untuk Pembeli Yang Pintar
- 10 Cara Memotivasi Anak Untuk Belajar Agar Menjadi Pintar
- Di Indonesia, (HAN) Hari Anak Nasional tanggal 23 Juli
- Ibu Hamil Dan Bahaya Kafein – Sayur & Buah Yang Baik Pada Masa Kehamilan
- Daftar Jenis Kanker: Pemahaman Kanker, Mengenal Dasar-Dasar, Contoh Kanker, Bentuk, Klasifikasi, Sel dan Pemahaman Penyakit Kanker Lebih Jelas
- Penyebab Dan Cara Mengatasi Iritasi Atau Lecet Akibat Pembalut Wanita
- Sistem Reproduksi Manusia, Hewan dan Tumbuhan
- Cara Mengenal Karakter Orang Dari 5 Pertanyaan Berikut Ini
- Kepalan Tangan Menandakan Karakter Anda & Kepalan nomer berapa yang Anda miliki?
Unduh / Download Aplikasi HP Pinter Pandai
Respons “Ooo begitu ya…” akan lebih sering terdengar jika Anda mengunduh aplikasi kita!
Siapa bilang mau pintar harus bayar? Aplikasi Ilmu pengetahuan dan informasi yang membuat Anda menjadi lebih smart!
Sumber bacaan: Science ABC, ThoughtCo, Socratic
Pinter Pandai “Bersama-Sama Berbagi Ilmu”
Quiz | Matematika | IPA | Geografi & Sejarah | Info Unik | Lainnya | Business & Marketing