Karbon Monoksida
Karbon monoksida dengan rumus kimia CO, adalah gas yang tak berwarna, tak berbau dan tak berasa.
Ia terdiri dari satu atom karbon yang secara kovalen berikatan dengan satu atom oksigen. Dalam ikatan ini, terdapat dua ikatan kovalen dan satu ikatan kovalen koordinasi antara atom karbon dan oksigen.
Dari Mana Karbon Monoksida Dihasilkan?
Karbon monoksida dihasilkan dari pembakaran tak sempurna dari senyawa karbon, sering terjadi pada mesin pembakaran dalam. Karbon monoksida terbentuk apabila terdapat kekurangan oksigen dalam proses pembakaran.
Pembakaran normal bahan bakar karbon (kayu, batu bara, gas alam, gas butana, minyak pemanas) melepaskan CO. Ketika pasokan oksigen tidak mencukupi, pembakaran tidak sempurna dan karbon monoksida terbentuk.
Sifat Karbon Monoksida
Karbon monoksida mudah terbakar dan menghasilkan lidah api berwarna biru, menghasilkan karbon dioksida.
Walaupun ia bersifat racun, CO memainkan peran yang penting dalam teknologi modern, yakni merupakan prekursor banyak senyawa karbon.
Bagaimana Cara Mengukur Tingkat Karbon Monoksida?
Sulit mendeteksi karbon monoksida tanpa menggunakan peralatan khusus. Karbon monoksida adalah gas mematikan yang tidak berwarna dan tidak berbau yang kadang-kadang dapat muncul di rumah. Mengukur kadar karbon monoksida mudah dilakukan dan merupakan bagian berharga dari keamanan rumah. Menyadari kadar karbon monoksida di rumah Anda akan memungkinkan Anda melindungi orang yang Anda cintai dari cedera atau kematian.
1. Beli monitor karbon monoksida. Mereka dapat ditemukan di toko perangkat keras atau pengecer seperti WalMart atau Target. Beberapa meter portabel, yang mana mereka berada, di mana yang lain dimaksudkan untuk dinding soket.
2. Tempatkan monitor karbon monoksida di dalam ruangan. Jika dicolokkan ke dinding, letakkan di soket yang lebih tinggi daripada yang rendah.
Baca manual instruksi untuk detail yang tepat tentang cara mendapatkan bacaan dari monitor Anda. Anda harus mendapatkan bacaan di bagian per juta, atau ppm. Menurut Komisi Keamanan Produk Konsumen, kadar lebih dari 70 ppm dapat menyebabkan perasaan sakit yang nyata, dan kadar di atas 150 ppm dapat menyebabkan kematian.
3. Karbon monoksida dapat diukur di rumah sakit. Tes jumlah karboksihemoglobin – kombinasi karbon monoksida dan hemoglobin yang membawa oksigen melalui aliran darah – dalam darah. Tes-tes ini paling baik dilakukan oleh seorang profesional.

Keracunan Karbon Monoksida
Keracunan karbon monoksida biasanya terjadi karena telah menghirup terlalu banyak karbon monoksida (CO).
Gejala
Gejala-gejalanya adalah sakit kepala, pusing, rasa letih, muntah, sakit dada, dan kebingungan. Jika jumlah karbon monoksida yang dihirup terlalu besar, korban dapat kehilangan kesadaran, mengalami aritmia, kejang-kejang, atau bahkan meninggal dunia.
“Kulit yang memerah seperti ceri” yang sering dideskripsikan sebagai gejala keracunan karbon monoksida sebenarnya jarang terjadi.
Komplikasi jangka panjang yang bisa muncul adalah rasa lelah, kesulitan mengingat, dan kesulitan bergerak.
Bagi mereka yang menghirup karbon monoksida dari asap, kasus keracunan sianida juga perlu dipertimbangkan.
Penyebab
Keracunan gas ini dapat terjadi secara tidak sengaja atau dengan sengaja untuk bunuh diri. CO adalah gas yang tidak berwarna dan tidak berbau dan juga awalnya tidak menyebabkan iritasi.[4] Gas ini dihasilkan dari pembakaran materi organik yang tidak sempurna[4] dari kendaraan bermotor, pemanas, atau alat memasak yang menggunakan bahan bakar berbasis karbon.
Keracunan juga dapat terjadi karena terpapar dengan metilen klorida. Karbon monoksida merupakan senyawa yang beracun karena dapat menyatu dengan hemoglobin untuk membentuk karboksihemoglobin (HbCO) yang membuat darah tidak dapat mengangkut oksigen.
Selain itu, mioglobin dan sitokrom oksidase mitokondrial juga terpengaruh. Diagnosis keracunan didasarkan pada kadar HbCO yang lebih tinggi dari 3% untuk mereka yang tidak merokok dan 10% untuk perokok. Risiko kematian pada mereka yang keracunan berkisar antara 1-30%.
Pencegahan
Keracunan dapat dicegah dengan memiliki detektor karbon monoksida, membuat ventilasi yang cukup, membersihkan cerobong, dan memastikan agar sistem buangan di kendaraan tetap dalam kondisi baik.
Perawatan dan Pengobatan
Untuk pasien yang sudah keracunan, mereka dapat dipulihkan dengan memberikan terapi oksigen 100% dan juga dengan memberikan perawatan suportif.
Tindakan ini perlu dilakukan hingga gejala udah tidak lagi muncul dan kadar HbCO lebih rendah dari 10%.
Keracunan karbon monoksida relatif sering terjadi; di Amerika Serikat, terdapat 20.000 kunjungan ke unit gawat darurat yang disebabkan oleh keracunan karbon monoksida.
Keracunan karbon monoksida merupakan jenis keracunan fatal yang paling sering terjadi di berbagai negara. Di Amerika Serikat, kasus yang tidak terkait dengan kebakaran menyebabkan lebih dari 400 kematian dalam satu tahun. Keracunan lebih sering terjadi pada musim dingin, khususnya akibat penggunaan genset saat mati lampu.
Produksi Karbon monoksida
Karbon monoksida merupakan senyawa yang sangat penting, sehingga banyak metode yang telah dikembangkan untuk produksinya.[1]
Gas produser dibentuk dari pembakaran karbon di oksigen pada temperatur tinggi ketika terdapat karbon yang berlebih. Dalam sebuah oven, udara dialirkan melalui kokas. CO2 yang pertama kali dihasilkan akan mengalami kesetimbangan dengan karbon panas, menghasilkan CO. Reaksi O2 dengan karbon membentuk CO disebut sebagai kesetimbangan Boudouard. Di atas 800 °C, CO adalah produk yang predominan:
- O2 + 2 C → 2 CO
- ΔH = -221 kJ/mol
Kerugian dari metode ini adalah apabila dilakukan dengan udara, ia akan menyisakan campuran yang terdiri dari nitrogen.
Gas sintetik atau gas air diproduksi via reaksi endotermik uap air dan karbon:
- H2O + C → H2 + CO
- ΔH = 131 kJ/mol
CO juga merupakan hasil sampingan dari reduksi bijih logam oksida dengan karbon:
- MO + C → M + CO
- ΔH = 131 kJ/mol
Oleh karena CO adalah gas, proses reduksi dapat dipercepat dengan memanaskannya. Diagram Ellingham menunjukkan bahwa pembentukan CO lebih difavoritkan daripada CO2 pada temperatur tinggi.
CO adalah anhidrida dari asam format. Oleh karena itu, adalah praktis untuk menghasilkan CO dari dehidrasi asam format. Produksi CO dalam skala laboratorium lainnya adalah dengan pemanasan campuran bubuk seng dan kalsium karbonat.
- Zn + CaCO3 → ZnO + CaO + CO
Metode laboratorium lainnya adalah dengan mereaksikan sukrosa dengan natrium hidroksida dalam sistem tertutup.
Reaksi Kimia Dasar
Penggunaan karbon monoksida dalam industri
Karbon monoksida adalah gas industri utama yang memiliki banyak kegunaan dalam produksi bahan kimia pukal (bulk chemical).
Sejumlah aldehida dengan hasil volume yang tinggi dapat diproduksi dengan reaksi hidroformilasi dari alkena, CO, dan H2.
Metanol diproduksi dari hidrogenasi CO. Pada reaksi yang berkaitan, hidrogenasi CO diikuti dengan pembentukan ikatan C-C, seperti yang terjadi pada proses Fischer-Tropsch, CO dihirogenasi menjadi bahan bakar hidrokarbon cair. Teknologi ini mengizinkan batu bara dikonversikan menjadi bensin.
Pada proses Monsanto, karbon monoksida bereaksi dengan metanol dengan keberadaan katalis rodium homogen dan HI, menghasilkan asam asetat. Proses ini digunakan secara meluas dalam produski asam asetat berskala industri.
Karbon monoksida merupakan komponen dasar dari syngas yang sering digunakan untuk tenaga industri. Ia juga digunakan pada proses pemurnian nikel.
Kimia koordinasi
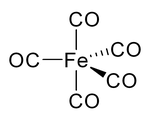
Pada nikel karbonil dan karbonil-karbonil lainnya, pasangan elektron pada karbon berinteraksi dengan logam; karbon monoksida menyumbangkan pasangan elektronnya kepada logam. Dalam situasi ini, karbon monoksida disebut sebagai ligan karbonil. Salah satu logam karbonil yang paling penting adalah besi pentakarbonil, Fe(CO)5:
Banyak kompleks logam-CO dihasilkan dari dekarbonilasi larutan organik dan bukannya dari CO.
Sebagai contoh, iridium(III) klorida dan trifenilfosfina bereaksi di metoksietanol mendidih atau dimetilformamida untuk menghasilkan IrCl(CO)(PPh3)2.
Kimia organik dan kimia golongan utama
Dengan keberadaan asam kuat dan air, karbon monoksida bereaksi dengan olefin membentuk asam karboksilat, proses ini dikenal sebagai reaksi Koch-Haaf.
Pada reaksi Gattermann-Koch, arena diubah menjadi turunan benzaldehida dengan keberadaan AlCl3 dan HCl.
Senyawa organologam seperti butil litiumdapat bereaksi dengan CO, namun reaksi ini jarang digunakan.
Walaupun CO bereaksi dengan karbokation dan karbanion, ia relatif tidak reaktif terhadap senyawa-senyawa organik tanpa intervensi katalis logam.
Dengan pereaksi golongan utama, CO mengalami beberapa reaksi yang penting. Klorinasi CO adalah salah satu lintasan industri yang penting untuk senyawa fosgena. Dengan borana, CO membentuk sebuah aduk (adduct) H3BCO yang bersifat isoelektrik dengan kation asilium, [H3CCO]+. CO bereaksi dengan natrium, menghasilkan Na2C2O2 (natrium asetilenadiolat) dari penggandengan (coupling) C-C, dan kalium, menghasilkan K2C2O2 (kalium asetilenadiolat) dan K2C6O6 (kalium rodizonat).
Karbon Monoksida di Atmosfer
Walaupun dianggap sebagai polutan
Telah lama ada di atmosfer sebagai hasil produk dari aktivitas gunung berapi. Ia larut dalam lahar gunung berapi pada tekanan yang tinggi di dalam mantel bumi. Kandungan karbon monoksida dalam gas gunung berapi bervariasi dari kurang dari 0,01% sampai sebanyak 2% bergantung pada gunung berapi tersebut.
Oleh karena sumber alami karbon monoksida bervariasi dari tahun ke tahun, sangatlah sulit untuk secara akurat menghitung emisi alami gas tersebut.
Memiliki efek radiative forcing secara tidak langsung
Dengan menaikkan konsentrasi metana dan ozon troposfer melalui reaksi kimia dengan konstituen atmosfer lainnya (misalnya radikal hidroksil OH–) yang sebenarnya akan melenyapkan metana dan ozon. Dengan proses alami di atmosfer, karbon monoksida pada akhirnya akan teroksidasi menjadi karbon dioksida. Konsentrasi karbon monoksida memiliki jangka waktu pendek di atmosfer.
CO antropogenik dari emisi automobil dan industri memberikan kontribusi pada efek rumah kaca dan pemanasan global. Di daerah perkotaan, karbon monoksida, bersama dengan aldehida, bereaksi secara fotokimia, meghasilkan radikal peroksi. Radikal peroksi bereaksi dengan nitrogen oksida dan meningkatkan rasio NO2 terhadap NO, sehingga mengurangi jumlah NO yang tersedia untuk bereaksi dengan ozon. Karbon monoksida juga merupakan konstituen dari asap rokok.
Peran Karbon monoksida dalam Fisiologi dan Makanan
Sistem kemasan dalam produk-produk daging segar
Digunakan dalam sistem kemasan Amerika Serikat, utamanya digunakan dalam produk-produk daging segar seperti daging kerbau dan babi. CO berkombinasi dengan mioglobin (protein dengan bentuk struktur bulat yang menyimpan oksigen dan terbentuk dari rantai polipeptida), membentuk karboksimioglobin, sebuah pigmen cerah yang berwarna merah ceri.
Karboksimioglobin lebih stabil dari bentuk mioglobin yang dioksigenasikan, yakni oksimioglobin, yang dapat dioksidasi menjadi pigmen coklat, metmioglobin. Warna merah yang stabil ini dapat bertahan lebih lama, sehingga memberikan kesan kesegaran. Kadar CO yang digunakan berkisar antara 0,4% sampai dengan 0,5%.
Untuk penggunaan sistem kemasan sekunder
Teknologi ini pertama kali diberikan status “Generally recognized as safe” (secara umum dikenal aman) oleh FDA pada tahun 2002 untuk penggunaan sistem kemasan sekunder. Pada tahun 2004, FDA mengizinkan penggunaan CO sebagai metode kemasan primer, menyatakan bahwa CO tidak menutupi bau busuk. Walaupun begitu, teknologi ini masih kontroversial di Amerika Serikat oleh karena kekhawatiran CO akan menutupi bau busuk makanan.
Mencegah beberapa penyakit
Diproduksi secara alami sebagai pemecahan dari heme (gugus prostetik yang terdiri dari atom besi yang terdapat di tengah-tengah cincin organik heterosiklik yang luas yang disebut porfirin), sebuah substrat untuk enzim heme oksigenase. Reaksi enzimatis ini memecahkan heme menjadi CO, biliverdin, dan Fe3+. CO yang diproduksi secara edogen kemungkinan memiliki peran fisiologis yang penting dalam tubuh (misalnya sebagai neurotransmiter atau pelemas pembuluh darah). Selain itu, CO meregulasi reaksi peradangan yang dapat mencegah berkembangnya beberapa penyakit seperti aterosklerosis atau malaria berat.
CO adalah nutrien bagi bakteri metanogen, sebuah blok pembangun untuk asetil koenzim A. Pada bakteri, CO diproduksi via reduksi karbon dioksida dengan enzom karbon monoksida dehirogenase, sebuah protein yang mengandung Fe-Ni-S.
Dikenal juga sebuah protein sensor-CO yang berdasarkan heme, CooA
Cakupan peranan biologis zat ini masih tidak jelas, namun tampaknya ia merupakan bagian dari lintasan signal pada bakteri dan arkea (satu domain atau kerajaan mikroorganisme bersel satu. Mikroba-mikroba ini adalah prokariota, berarti mereka tidak memiliki inti sel atau organel dibatasi-membran lainnya di dalam selnya).
CO juga baru-baru ini dikaji di beberapa laboratorium riset di seluruh dunia atas sifatnya yang anti-peradangan dan sitoprotektif yang dapat digunakan untuk terapi pencegahan kondisi patologis seperti cedera reperfusi iskemia, penolakan trasplan, aterosklerosis, spesi, malaria berat, atau autoimunitas. Sampai sekarang ini tidak ada aplikasi medis CO kepada manusia.
Sejarah Karbon Monoksida
Dihasilkan oleh kimiawan Prancis de Lassone
Pertama kali dihasilkan oleh kimiawan Prancis de Lassone pada tahun 1776 dengan memanaskan seng oksida dengan kokas. Dia menyimpulkan bahwa gas yang dihasilkan adalah hidrogen karena ketika dibakar ia menghasilkan lidah api berwarna biru. Gas ini kemudian diidentifikasi sebagai senyawa yang mengandung karbon dan oksigen oleh kimiawan Inggris William Cumberland Cruikshank pada tahun 1800.
Sifat-sifat CO yang beracun pertama kali diinvestigasi secara saksama oleh fisiolog Prancis Claude Bernard sekitar tahun 1846. Dia meracuni beberapa anjing dengan gas tersebut, dan mendapatkan bahwa darah anjing-anjing tersebut berwarna lebih merah di seluruh pembuluh darah.
Selama Perang Dunia II
Digunakan untuk menjaga kendaraan bermotor tetap berjalan di daerah-daerah yang kekurangan bensin. Pembakar batu-bara atau kayu dipasangkan, dan karbon monoksida yang diproduksi dengan gasifikasi dialirkan ke karburetor. CO dalam kasus ini dikenal sebagai “gas kayu”
Karbon monoksida juga dilaporkan digunakan dalam skala kecil selama Holocaust di beberapa kamp eksterminasi Nazi dan di program “eutanasia” Aksi T4 (adalah program Nazi yang resminya berlangsung antara tahun 1939 dan 1941, dan sepanjang masa tersebut Adolf Hitler telah melakukan pembunuhan secara sistematis terhadap 200.000 hingga 250.000 penderita kelainan genetika).
Struktur Molekul Karbon monoksida
Molekul CO memiliki panjang ikat 0,1128 nm. Perbedaan muatan formal dan elektronegativitas saling meniadakan, sehingga terdapat momen dipol yang kecil dengan kutub negatif di atom karbon walaupun oksigen memiliki elektronegativitas yang lebih besar.
Alasannya adalah orbital molekul yang terpenuhi paling tinggi memiliki energi yang lebih dekat dengan orbital p karbon, yang berarti bahwa terdapat rapatan elektron yang lebih besar dekat karbon. Selain itu, elektronegativitas karbon yang lebih rendah menghasilkan awan elektron yang lebih baur, sehingga menambah momen dipol. Ini juga merupakan alasan mengapa kebanyakan reaksi kimia yang melibatkan karbon monoksida terjadi pada atom karbon, dan bukannya pada atom oksigen.
Panjang ikatan molekul karbon monoksida sesuai dengan ikatan rangkap tiga parsialnya. Molekul ini memiliki momen dipol ikatan yang kecil dan dapat diwakili dengan tiga struktur resonansi:
Resonans paling kiri adalah bentuk yang paling penting. Hal ini diilustrasikan dengan reaktivitas karbon monoksida yang bereaksi dengan karbokation (yang sebelumnya disebut ion karbonium).
Semua karbokation membawa satu muatan positif pada sebuah atom karbon. Disebut karbokation karena sebuah kation adalah sebuah ion positif, dan “karbo” menunjuk pada sebuah atom karbon. Akan tetapi, ada perbedaan penting dalam hal struktur berbagai jenis karbokation.
Dinitrogen bersifat isoelektronik terhadap karbon monoksida. Hal ini berarti bahwa molekul-molekul ini memiliki jumlah elektron dan ikatan yang mirip satu sama lainnya. Sifat-sifat fisika antara N2 dan CO sangat mirip, walaupun CO lebih reaktif.
Bacaan Lainnya
- Karbon Dioksida (zat asam arang): Rumus Kimia CO2 – Cara Hitung Emisi Karbon
- Jenis Tanah: Alfisol, Andisol, Aridisol, Entisol, Gelisol, Histosol, Inceptisol, Mollisol, Oxisol, Spodosol, Ultisol, Vertisol (Bersama Contoh Soal dan Jawaban)
- 10 Cara Menghindari Sambaran Petir
- Jenis Bencana Alam – Iklim, Alam, Wabah, Ruang Angkasa – Dampak, Penanggulangan dan Contoh
- Penyakit Paling Umum Selama Musim Hujan
- Daftar Gunung Berapi di Indonesia
- Longsor Bawah Laut – Penjelasan dan Penyebab
- Penyebab Tsunami
- Cara Melindungi Diri Saat Gunung Berapi Meletus
- Gunung Agung Terkini dan Sejarah Erupsi Gunung Agung di Bali
- Letusan Gunung Samalas 1257 di Lombok Menyebakan Cuaca Ekstrem Dunia
- Vulkano / Gunung Berapi Gunung yang terbentuk di sekitar lubang atau bukaan di tanah
- Jatuh di Lava – Apa Yang Terjadi Jika Anda Terjatuh Dalam Lava? Apa yang terjadi pada tubuh Anda?
- Hari Kesiapsiagaan Bencana Nasional Diperingati Setiap Tanggal 26 April – Cara-Cara Untuk Melindungi Diri dari Bencana
- Pengertian Peringatan Gunung Berapi – Tingkat Aktivitas Level 1-4 di Indonesia
- Hasil letusan gunung berapi: gas vulkanik, lava, lahar, hujan abu, awan panas
- Daftar Gunung Berapi di Indonesia
- Contoh Soal UN Kimia Beserta Jawabannya
- Berapa Kecerdasan IQ Anda? Tes IQ Anda Disini
- 10 Cara Belajar Pintar, Efektif, Cepat Dan Mudah Di Ingat – Untuk Ulangan & Ujian Pasti Sukses!
- Tulisan Menunjukkan Kepribadian Anda & Bagaimana Cara Anda Menulis?
- Penyakit yang dapat dicegah dengan vaksin – Wajib diketahui
- Top 10 Sungai Terpanjang Di Dunia
- Tempat Wisata Yang Wajib Dikunjungi Di Indonesia Dan Luar Negri
- Kepalan Tangan Menandakan Karakter Anda & Kepalan nomer berapa yang Anda miliki?
- Bentuk Kaki Menandakan Karakter Anda – Bentuk Kaki nomer berapa yang Anda miliki?
Unduh / Download Aplikasi HP Pinter Pandai
Respons “Ooo begitu ya…” akan lebih sering terdengar jika Anda mengunduh aplikasi kita!
Siapa bilang mau pintar harus bayar? Aplikasi Ilmu pengetahuan dan informasi yang membuat Anda menjadi lebih smart!
Sumber bacaan: Ehow, Pubchem, Science Daily
Pinter Pandai “Bersama-Sama Berbagi Ilmu”
Quiz | Matematika | IPA | Geografi & Sejarah | Info Unik | Lainnya | Business & Marketing